发布时间:2021-10-22 为加强医疗器械注册管理,规范注册申请人注册自检工作,确保医疗器械注册检验工作有序开展,根据《医疗器械监督管理条例》(国务院令第
发布时间:2021-11-04各省、自治区、直辖市药品监督管理局,新疆生产建设兵团药品监督管理局: 为落实《医疗器械监督管理条例》(国务院令第739号)要求,
发布时间:2021-12-30 为有效预防、及时控制和消除突发公共卫生事件的危害,确保突发公共卫生事件应急所需医疗器械尽快完成审批,根据《医疗器械监督管理条例
发布时间:2018-09-30 为进一步明确管理者代表在质量管理体系中的职责,强化医疗器械生产企业质量主体责任意识,提升质量管理水平,根据《医疗器械生产监督管
发布时间:2022-03-24 为加强医疗器械生产监管,保障医疗器械安全有效,根据《医疗器械监督管理条例》第三十五条第二款规定,国家药品监督管理局组织修订了《
发布时间:2021-09-27 为指导体外诊断试剂临床试验工作,根据《体外诊断试剂注册与备案管理办法》(国家市场监督管理总局令第48号),国家药监局组织制定了
发布时间:2018-01-11 为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),加强医
发布时间:2018-01-08 为贯彻落实中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号),加强医
发布时间:2022-03-31 《医疗器械临床试验质量管理规范》(2022年第28号)(以下简称《规范》)已经发布,自2022年5月1日起施行。为做好《规范》
医疗器械不良事件监测和再评价管理办法(2018年8月13日国家市场监督管理总局、国家卫生健康委员会令第1号公布 自2019年1月1日起施行)第一章 总 则 第
医疗器械网络销售监督管理办法(2017年12月20日国家食品药品监督管理总局令第38号公布 自2018年3月1日起施行)第一章 总 则 第一条 为加强医疗器械
医疗器械标准管理办法(2017年4月17日国家食品药品监督管理总局令第33号公布 自2017年7月1日起施行)第一章 总 则 第一条 为促进科学技术进步,保障
国家食品药品监督管理总局关于调整部分医疗器械行政审批事项审批程序的决定(2017年3月20日国家食品药品监督管理总局令第32号公布 自2017年7月1日起施行)
医疗器械召回管理办法(2017年1月25日国家食品药品监督管理总局令第29号公布 自2017年5月1日起施行)第一章 总 则 第一条 为加强医疗器械监督管理,
发布时间:2022-03-31 为深化医疗器械审评审批制度改革,加强医疗器械临床试验管理,根据《医疗器械监督管理条例》(国务院令第739号)及《医疗器械注册与
医疗器械通用名称命名规则(2015年12月21日国家食品药品监督管理总局令第19号公布 自2016年4月1日起施行) 第一条 为加强医疗器械监督管理,保证医疗
医疗器械使用质量监督管理办法(2015年10月21日国家食品药品监督管理总局令第18号公布 自2016年2月1日起施行)第一章 总 则 第一条 为加强医疗器械
药品医疗器械飞行检查办法(2015年6月29日国家食品药品监督管理总局令第14号公布 自2015年9月1日起施行)第一章 总 则 第一条 为加强药品和医疗器械
医疗器械经营监督管理办法(2022年3月10日国家市场监督管理总局令第54号公布 自2022年5月1日起施行)第一章 总 则 第一条 为了加强医疗器械经
- YY/T
- GB/T
- 指导原则
- 器械产品
- 器械通告
-

YY/T 1859-2022 动物源性心血管植入物抗钙化评价 大鼠皮下植入试验2025-02-23
本文件按照 GB/T 1.1-2020《标准化工作导则第1部分:标准化文件的结构和起草规则》的规定起草。 请注意本文件的某些内容可能涉及专利。本文件的发布机构不
安全下载 -

YY 0315-2023 钛及钛合金牙种植体2025-02-22
本文件按照 GB/T 1.1-2020《标准化工作导则 第1部分:标准化文件的结构和起草规则》的规定起草。 本文件代替 YY 0315—2016《钛及钛合金牙种
安全下载 -

YY 0304-2023 等离子喷涂羟基磷灰石涂层 钛基牙种植体2025-02-22
本文件按照GB/T 1.1-2020《标准化工作导则 第1部分:标准化文件的结构和起草规则》的规定起草。 本文件代替 YY 0304-2009《等离子喷涂羟基磷
安全下载 -

YY/T 0127.19-2023 口腔医疗器械生物学评价 第19部分:亚急性和亚慢性全身毒性试验:植入途径2025-02-22
本文件按照 GB/T 1.1-2020《标准化工作导则 第1部分:标准化文件的结构和起草规则》的规定起草。本文件是 YY/T 0127《口腔医疗器械生物学评价》
安全下载 -

YY/T 0127.4-2023 口腔医疗器械生物学评价 第4部分:骨植入试验2025-02-22
本文件是 YY/T 0127《口腔医疗器械生物学评价》的第4部分。YY/T0127 已经发布了以下部分: YY/T 0127.1《口腔材料生物试验方法 溶血试验...
安全下载 -

YY/T 1851-2022 用于增材制造的医用纯钽粉末2025-02-22
本文件按照 GB/T 1.1—2020《标准化工作导则 第1部分:标准化文件的结构和起草规则》的规定起草。 请注意本文件的某些内容可能涉及专利。本文件的发布机构
安全下载 -

YY/T 0285.6-2020 血管内导管 一次性使用无菌导管 第6部分:皮下植入式给药装置2025-02-22
YY/T 0285的本部分规定了以无菌状态供应、一次性使用的皮下植入式给药装置的相关性能和安全要求。本部分适用于预期在血管内长期或持久使用、由皮下植入式输液港和
安全下载 -

YY/T 0285.5-2018 血管内导管 一次性使用无菌导管 第5部分:套针外周导管2025-02-22
YY 0285《血管内导管 一次性使用无菌导管》分为以下几部分: ——第1部分:通用要求; ——第3部分:中心静脉导管; 第4部分:球囊扩张导管; 第5部分:套
安全下载 -

YY 0285.1-2017 血管内导管 一次性使用无菌导管 第1部分:通用要求2025-02-22
关于规范性引用文件,本部分做了具有技术性差异的调整,以适应我国的技术条件,调整的情 况集中反映在第2章“规范性引用文件”中,具体调整如下: 用等同采用国际标准的...
安全下载
-

GB/T 14926.52-2001 实验动物 免疫荧光试验2025-07-15
含有病毒抗原的细胞(组织培养细胞或动物组织细胞)固定于玻片上,遇相应抗体形成抗原抗体复合物。
安全下载 -
GB/T 14926.51-2001 实验动物 免疫酶试验2025-07-15
GB/T,,动物试验,动物实验,实验动物,免疫酶试验
安全下载 -

GB/T 14926.50-2001 实验动物 酶联免疫吸附试验2025-07-14
本标准规定了酶联免疫吸附试验(ELISA)所用试剂、器材和操作步骤等。
安全下载 -
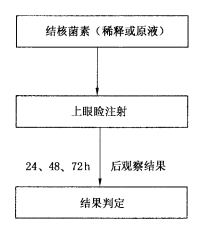
GB/T 14926.48-2001 实验动物 结核分枝杆菌检测方法2025-07-13
下列标准所包含的条文,通过在本标准中引用而构成为本标准的条文。本标准出版时,所示版本均为有效。所有标准都会被修订,使用本标准的各方应探讨使用下列标准最新版本的可...
安全下载 -

GB/T 14926.49-2001 实验动物 空肠弯曲杆菌检测方法2025-07-13
本标准是对GB/T14926.18-1994《实验动物 巴细胞脉络丛脑膜炎病毒检测方法》的修订。本标准删除了GB/T14926.18-1994中“酶联免疫吸附试...
安全下载 -
GB/T 14926.41-2001 实验动物 无菌动物生活环境及粪便标本的检测方法2025-07-11
本标准规定了无菌动物生活环境及粪便标本中细菌的检测方法,本标准适用于无菌小鼠、大鼠、豚鼠,地鼠和免的微生物检测。
安全下载 -
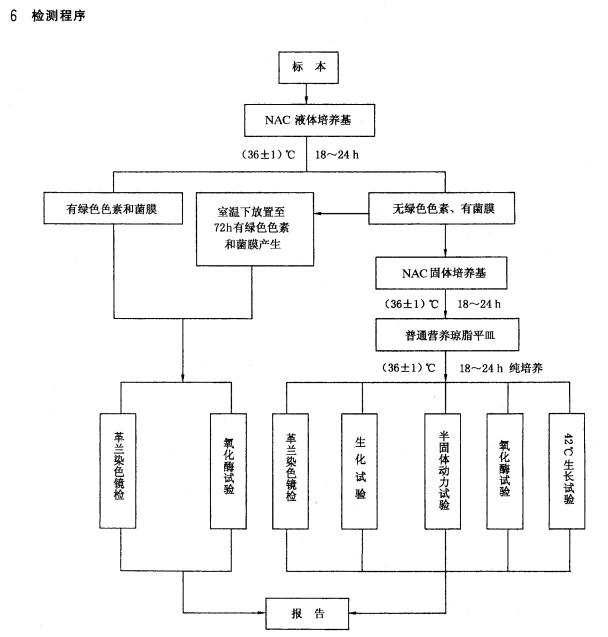
GB/T 14926.17-2001 实验动物 绿脓杆菌检测方法2025-07-11
本标准增加了“6.3.5半固体动力试验”和“6.3.642℃生长试验"和“5检验程序”。因血清型鉴别试剂难得,且血清型鉴别只是必要时才采用,故制除原标...
安全下载 -
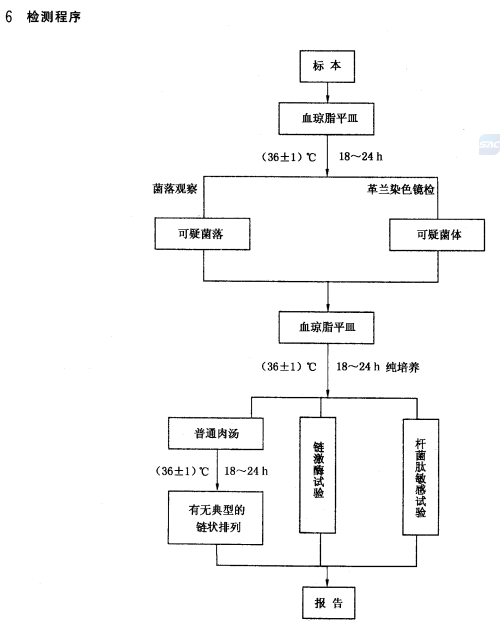
GB/T 14926.16-2001 实验动物 乙型溶血性链球菌检测方法2025-07-11
本标准适用于小鼠、大鼠、豚鼠、地鼠和兔乙型溶血性链球菌的检测。
安全下载 -
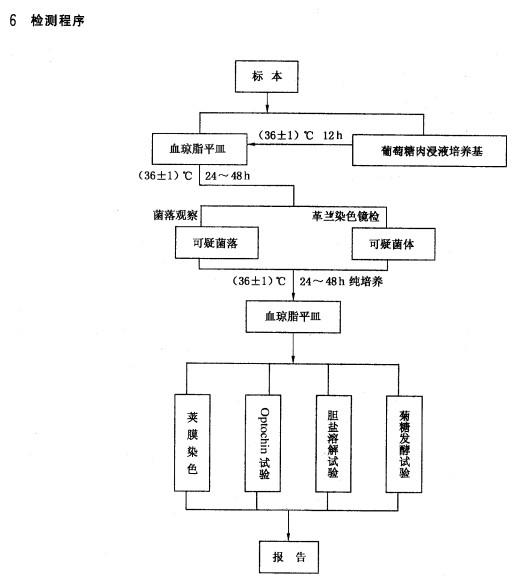
GB/T 14926.15-2001 实验动物 肺炎链球菌检测方法2025-07-11
本标准适用于小鼠、大鼠、豚鼠、地鼠和免肺炎链球菌的检测。
安全下载
-

药物涂层球囊扩张导管注册审查指导原则(2023年第9号)2025-02-23
本指导原则旨在指导注册申请人对药物涂层球囊扩张导管注册申报资料的准备及撰写,同时也为技术审评部门对药物涂层球囊扩张导管注册申报资料的技术审评提供参考。本指导原则
安全下载 -

主动脉覆膜支架系统临床试验指导原则(2019年第8号)2025-02-23
为了进一步规范主动脉覆膜支架系统产品上市前的临床试验,并指导该类产品申请人在申请产品注册时临床试验资料的准备,制订本指导原则。本指导原则系对主动脉覆膜支架系统临
安全下载 -

生物可吸收冠状动脉药物洗脱支架动物实验研究指导原则(2020年第48号)2025-02-23
为了进一步规范生物可吸收冠状动脉药物洗脱支架(下简称生物可吸收支架)产品动物实验研究,并指导该类产品注册申请人在申请产品注册时申报资料的准备,制订本指导原则。本
安全下载 -

生物可吸收冠状动脉药物洗脱支架临床试验指导原则(2019年第8号)2025-02-23
为了进一步规范生物可吸收冠状动脉药物洗脱支架产品上市前的临床试验,并指导该类产品申请人在申请产品注册时临床试验资料的准备,制订本指导原则。本指导原则系对生物可吸
安全下载 -

冠状动脉药物洗脱支架临床试验指导原则(2018年第21号)2025-02-23
为了进一步规范冠状动脉药物洗脱支架产品上市前的临床试验,并指导该类产品申请人在申请产品注册时临床试验资料的准备,制订本指导原则。本指导原则系对冠状动脉药物洗脱支
安全下载 -

经鼻胆汁外引流管注册审查指导原则(2022年第41号)2025-02-22
本指导原则旨在指导和规范经鼻胆汁外引流管产品的注册申报工作,帮助申请人理解和掌握该类产品的原理/机理、结构、主要风险、性能、预期用途等内容,用来指导申请人准备和
安全下载 -

一次性使用引流管产品注册审查指导原则(2024年第21号)2025-02-22
本指导原则旨在帮助和指导注册申请人对一次性使用引流管注册申报资料的准备及撰写,同时也为医疗器械技术审评部门对注册申报资料的技术审评提供参考。本指导原则是对一次性
安全下载 -

中心静脉导管产品注册技术审查指导原则2025-02-22
本指导原则旨在帮助和指导申请人对中心静脉导管产品注册申报资料进行准备,以满足技术审评的基本要求。同时有助于审评机构对该类产品进行科学规范的审评,提高审评工作的质
安全下载 -

植入式左心室辅助系统注册技术审查指导原则2025-02-22
本指导原则是对植入式左心室辅助系统的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化。申请人还应依据具体产品的特性确定其中的具体内容是否适
安全下载
-

可吸收硬脑膜封合医用胶(CQZ1600326)2025-02-20
该申报产品为按照创新医疗器械特别审批程序审批项目,编号 2014009。申请人的注册申报资料符合现行要求。依据《医疗器械监督管理条例》(国务院令第 680 号)
安全下载 -

颅内动脉瘤栓塞辅助支架(CQZ2400092)2024-10-24
该 产 品 属 于 创 新 医 疗 器 械 ( 创 新 审 查 受 理 号 :CQTS2200041)。申请人的注册申报资料符合现行要求。依据《医疗器械监督管理
安全下载 -

颅内动脉瘤CT造影图像辅助检测软件(CQZ2302223)2024-09-20
申请人申请境内三类医疗器械注册,该产品为创新医疗器械(创新编号:CQTS2300240),注册申报资料齐全,符合现行要求。依据《医疗器械监督管理条例》(国务院令
安全下载 -

肺栓塞CT血管造影图像辅助分诊软件(CQZ2400084)2024-09-13
申请人申请境内第三类医疗器械注册,注册申报资料齐全,符合现行要求。依据《医疗器械监督管理条例》(国务院令第 739 号)、《医疗器械注册与备案管理办法》(国家市
安全下载 -

丝素蛋白疝修补补片(CQZ2101078)2024-03-13
申请人的注册申报资料符合现行要求,依据《医疗器械监督管理条例》(国务院令第 739 号)、《医疗器械注册与备案管理办法》(国家市场监督管理总局令第 47 号)等
安全下载 -

颅内取栓支架(JQZ2200082)2023-08-16
该 产 品 属 于 创 新 医 疗 器 械 ( 创 新 审 查 受 理 号 :CQTS2000025)。申请人的注册申报资料符合现行要求。依据《医疗器械监督管理
安全下载 -

生物疝修补补片(CQZ2100193)2021-11-02
本申报产品属于创新医疗器械(创新编号:CQTS1800126)。 申请人的注册申报资料符合现行要求,依据《医疗器械监督管理条例》(国务院令第 739 号)、《医
安全下载 -

复合疝修补补片(CQZ1600412)2018-08-02
本申报产品属于创新医疗器械特别审批项目,编号2015045。申请人的注册申报资料符合现行要求,依据《医疗器械监督管理条例》(国务院令第 680 号)、《医疗器械
安全下载
















