造血干/祖细胞(hematopoietic stem and progenitor cells, HSPCs)具有自我更新和多向分化潜能,是维持终生造血稳态的关键细胞。在脊椎动物中,HSPCs最早产生于主动脉-性腺-中肾区(aorta-gonad-mesonephros, AGM),然后迁移至哺乳动物胎肝或斑马鱼的尾部造血组织(caudal hematopoietic tissue, CHT)进行扩增,最终定植于终生造血器官(哺乳动物骨髓或斑马鱼的肾髓)维持造血稳态[1,2]。在这一过程中,HSPCs经历了不同细胞状态、转录特征和功能特性的转变,然而调控不同发育阶段HSPC转录组重编程的分子机制尚未被充分挖掘。
动态RNA修饰是遗传信息调控的新层面,在HSPC特化、扩增和分化过程中发挥关键作用[3-5]。RNA 5-甲基胞嘧啶(5-methylcytosine, m5C)修饰及其效应分子通过调控RNA代谢,参与胚胎发育和肿瘤发生等多种生物学过程[6]。然而,m5C修饰是否也在造血发育过程中调控转录特征的变化尚不清楚。
2025年2月25日,中国医学科学院血液病医院(中国医学科学院血液学研究所)王璐研究员、国家生物信息中心杨莹青年研究员、中国科学院动物研究所刘峰研究员、国家生物信息中心杨运桂研究员合作在Cell Reports杂志发表封面文章“RNA m5C Methylation Mediated by Ybx1 Ensures Hematopoietic Stem and Progenitor Cell Expansion”,揭示造血发育过程中RNA m5C修饰的动态变化,发现Ybx1通过识别m5C修饰,稳定细胞周期相关转录本,促进HSPC扩增。

研究人员首先利用斑马鱼模型,通过转录组测序和RNA亚硫酸盐测序(bisulfite-sequencing, BisSeq),描绘了AGM区新生HSPC、CHT区HSPC和成体肾髓区HSPC的转录和RNA m5C水平的动态变化规律,发现RNA m5C偏好于修饰阶段功能特异性转录本,其水平在CHT区HSPC中特异性升高。并且从AGM区新生HSPC发育至CHT区HSPC过程中,m5C修饰水平增加的转录本往往具有更稳定的表达。进一步分析发现,m5C修饰识别蛋白ybx1在CHT区 HSPC中高表达。功能缺失实验和回救实验验证了Ybx1调控CHT区HSPC扩增,并且这一调控作用依赖于Ybx1的m5C位点识别及结合能力。转录组、RNA BisSeq和Ybx1 RNA免疫沉淀测序(RNA immunoprecipitation sequencing, RIP-seq)分析和功能实验表明,Ybx1主要结合含有m5C修饰的细胞周期相关转录本,如cyclin d1和mcm6,并维持其稳定性。ybx1缺失后HSPC增殖能力降低,细胞周期阻滞于G0/G1期。最后,研究人员发现Ybx1缺失显著降低小鼠胎肝Lineage-Sca-1+c-Kit+(LSK)HSPC比例,抑制HSPC增殖,并影响细胞周期相关mRNA的稳定性,表明Ybx1在小鼠胎肝HSPC中的功能是保守的。
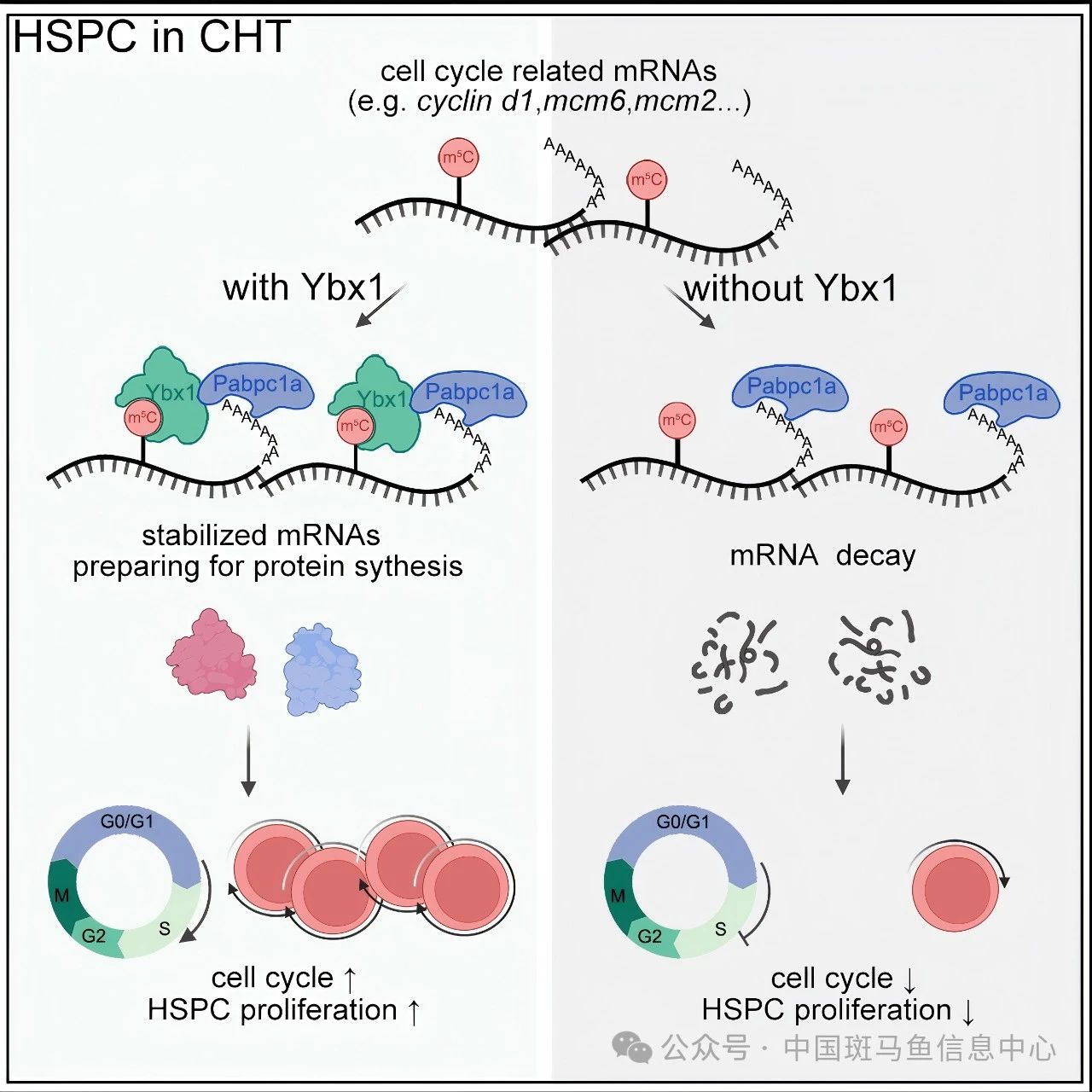
综上所述,该研究揭示了RNA m5C修饰在HSPC发育中的动态变化,发现Ybx1通过稳定m5C修饰的细胞周期相关转录本,促进HSPC扩增。这一发现丰富了我们对HSPC发育的表观转录组调控机制的理解,为优化HSPC体外扩增策略提供了新的理论基础和潜在靶点。

中国医学科学院血液病医院(中国医学科学院血液学研究所)王璐研究员、国家生物信息中心杨莹青年研究员、中国科学院动物研究所刘峰研究员以及国家生物信息中心杨运桂研究员为共同通讯作者,中国医学科学院血液病医院(中国医学科学院血液学研究所)博士生刘帆、国家生物信息中心特别研究助理王梦柯博士和山东大学生命科学学院高素伟博士为共同第一作者。该研究得到了国家重点研发计划、国家自然科学基金、天津市杰出青年科学基金、中国科学院青年创新促进会以及中国博士后科学基金等项目资助。
参考文献1. Dzierzak, E., and Bigas, A. (2018). Blood Development: Hematopoietic Stem Cell Dependence and Independence. Cell stem cell 22, 639-651. 10.1016/j.stem.2018.04.015.2. Laurenti, E., and Göttgens, B. (2018). From haematopoietic stem cells to complex differentiation landscapes. Nature 553, 418-426. 10.1038/nature25022.3. Zhang, C., Chen, Y., Sun, B., Wang, L., Yang, Y., Ma, D., Lv, J., Heng, J., Ding, Y., Xue, Y., et al. (2017). m(6)A modulates haematopoietic stem and progenitor cell specification. Nature 549, 273-276. 10.1038/nature23883.4. Li, Z., Qian, P., Shao, W., Shi, H., He, X.C., Gogol, M., Yu, Z., Wang, Y., Qi, M., Zhu, Y., et al. (2018). Suppression of m(6)A reader Ythdf2 promotes hematopoietic stem cell expansion. Cell research 28, 904-917. 10.1038/s41422-018-0072-0.5. 刘帆, 王璐 (2020). RNA修饰调控造血发育和白血病发生的研究进展 中国科学:生命科学. 50, 827-835.6. Gao, Y., and Fang, J. (2021). RNA 5-methylcytosine modification and its emerging role as an epitranscriptomic mark. RNA biology 18, 117-127. 10.1080/15476286.2021.1950993.






