中性粒细胞(neutrophil)是应对外来病原体最重要的先天免疫细胞之一,约占人体所有白细胞数量的40-70%,在维持机体稳态中至关重要。中性粒细胞数量改变或者功能紊乱会导致严重的血液和免疫系统疾病。中性粒细胞源于粒–单核祖细胞(GMPs),经幼粒细胞和前粒细胞阶段逐步成熟。已有研究表明,PU.1、RUNX1、IRF8以及C/EBP等转录因子在粒细胞发育和成熟中不可或缺[1-3]。受细胞因子激活的多个信号通路,如JAK–STAT信号的STAT3和STAT5在中性粒细胞的增殖、分化、成熟乃至凋亡过程中发挥关键作用[4-5]。尽管如此,粒–单核祖细胞分化为成熟粒细胞的转录因子与信号通路仍未被完全阐明。围绕这一科学问题,中国科学院重庆绿色智能技术研究院李礼课题组结合细胞系与斑马鱼、小鼠等动物模型展开了系统性探索。
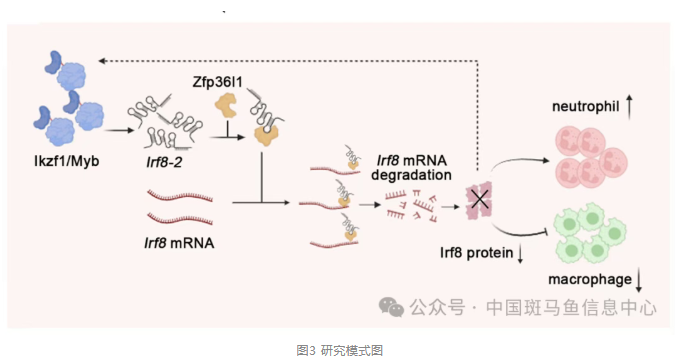
近日,中国科学院重庆绿色智能技术研究院李礼课题组在PNAS上发表了题为"Regulation of a lncRNA irf8 by the Ikzf1/Myb complex drives neutrophil development"的研究论文。研究团队发现转录因子Ikzf1与Myb形成复合体,共同作用于irf8基因组的一个特异性调控元件,诱导长链非编码RNA irf8-2的表达。irf8-2抑制Irf8的活性进而调控中性粒细胞的产生和成熟。该研究揭示了粒细胞发育的新机制。

在斑马鱼的原始造血过程中,胚胎期的髓系前体细胞可分化为粒细胞和巨噬细胞。本研究利用谱系追踪验证标记髓系细胞的转基因系Tg(coro1a:DsRed)无偏差标记粒细胞和巨噬细胞。对coro1a-DsRed标记的髓系细胞进行单细胞转录组分析,结果提示ikzf1和myb高表达在偏向粒细胞命运的髓系前体细胞群(cluster)。随后,研究者构建了Tg(coro1a:HA-ikzf1)和Tg(coro1a:FLAG-myb)过表达品系,以及ikzf1Δ4+3/Δ4+3; mybhkz3/hkz3双突变品系。结果显示过表达Ikzf1/Myb可促进粒细胞生成并抑制巨噬细胞产生;而Ikzf1/Myb在双突变体中几乎检测不到粒细胞,同时巨噬细胞数量显著增加。这些结果表明Ikzf1/Myb在髓系前体细胞分化为粒细胞中至关重要。
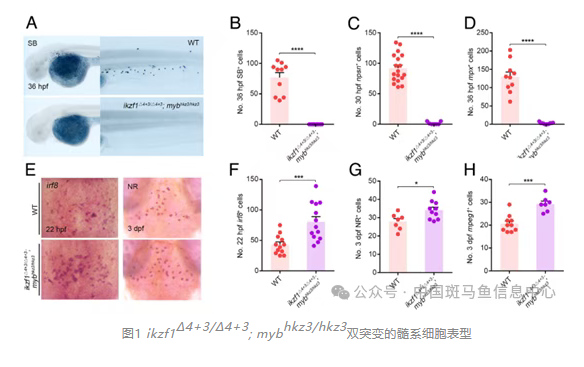
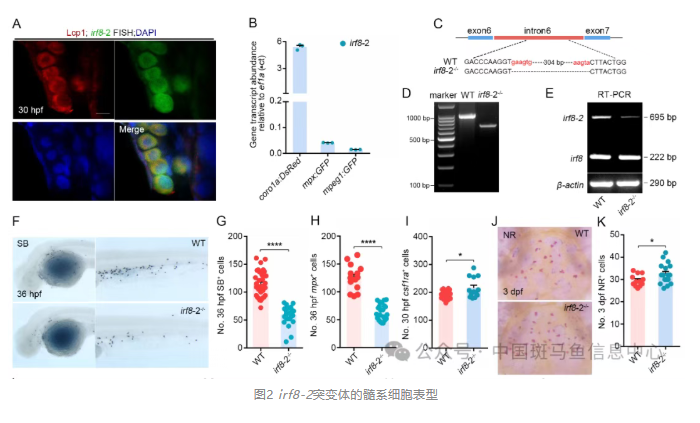
进一步分选野生型与Ikzf1/Myb双突变的coro1a-DsRed+髓系细胞,进行Smart-seq、ATAC-seq、单细胞转录组、染色质免疫共沉淀以及荧光报告实验。结果显示Ikzf1/Myb结合irf8基因组转录起始位点下游约1.6 kb的区域,调控一个先前未被报道的irf8新转录本。通过RACE实验、生物信息学分析及蛋白印迹实验,课题组最终揭示该转录本为长链非编码RNA,命名为irf8-2。随后实验结果表明,irf8-2在髓系前体细胞中高表达;课题组在irf8基因的第6个内含子上设计了三个CRISPR/Cas9的gRNA靶点,并采用crispant技术进行基因编辑。最终获得了一个304bp缺失的irf8-2突变体。构建的irf8-2突变体不影响irf8本底RNA的表达和功能,但重现Ikzf1/Myb双突变体的表型,且该表型可被过表达irf8-2部分拯救。
进一步结果提示irf8-2能与RNA结合蛋白zfp36l1互作。zfp36l1可结合irf8 mRNA 3′-UTR的ARE元件并促进其降解,从而驱动髓系前体细胞向粒细胞分化。挽救实验表明,Ikzf1/Myb双突变体中敲降irf8能够部分恢复髓系细胞的分化异常表型。
课题组又进一步探讨了irf8-2在小鼠中的保守性。鉴于长链非编码RNA具有位置相似性,课题组分析已发表的小鼠粒–单核祖细胞(GMP)、共同单核祖细胞(cMoPs)和中性粒细胞祖细胞(proNeu)的RNA-seq数据,以及GMP的ATAC-seq数据,结果显示irf8-2在小鼠中同样存在。最后,小鼠骨髓移植实验结果进一步确认Irf8-2介导的Ikzf1/Myb与Irf8互作在调控哺乳动物粒细胞分化中机制保守。
该研究系统揭示了转录因子复合物Ikzf1/Myb在粒细胞发育过程中所发挥着关键作用;发现并鉴定了一个irf8的新转录本作为长链非编码RNA(irf8-2)的生物学功能;揭示了转录因子复合物Ikzf1/Myb可通过irf8-2抑制Irf8的表达,从而调控髓系细胞分化的全新机制。这一发现不仅深化了对粒细胞发育机理的理解,也为相关血液疾病的机制解析和治疗提供新的切入点。
中国科学院重庆绿色智能技术研究院博士何跃鹏为论文第一作者。中国科学院重庆绿色智能技术研究院李礼研究员为通讯作者。该研究得到复旦大学罗凌飞教授、重庆医科大学侯宇教授和李志刚副教授、西南大学赵方莹副教授的指导和帮助,以及国家重点研发计划(2023YFA1800100)等项目的资助。文中构建的过表达品系和双突变品系,即将通过国家水生生物种质资源库国家斑马鱼资源中心对外提供。
参考文献
[1] myelo-erythroid progenitor cell fate in zebrafish[J]. Developmental Cell, 2005, 8(1): 97-108.
[2] Jin H, Li L, Xu J, et al. Runx1 regulates embryonic myeloid fate choice in zebrafish through a negative feedback loop inhibiting Pu.1 expression[J]. Blood, 2012, 119(22): 5239-5249.
[3] Avellino R, Havermans M, Erpelinck C, et al. An autonomous CEBPA enhancer specific for myeloid-lineage priming and neutrophilic differentiation[J]. Blood, 2016, 127(24): 2991-3003.
[4] Zhang M, Meng Y, Ying Y, et al. Selective activation of STAT3 and STAT5 dictates the fate of myeloid progenitor cells[J]. Cell Death Discovery, 2023, 9(1): 1-11.
[5] Zhang F, Xia Y, Su J, et al. Neutrophil diversity and function in health and disease[M/OL]//Signal Transduction and Targeted Therapy: Vol. 9. Springer US, 2024.






