肾单位是肾脏结构与功能的基本组成单元,人类双侧肾脏约含两百万个肾单位。肾单位的进行性丧失被认为是肾功能减退的核心病理基础[1]。鉴于负责生成哺乳动物肾单位的胚胎期肾脏祖细胞于围产期即告耗竭,成年个体在遭受肾损伤后仅能启动有限的修复机制挽救残存肾单位,而缺乏再生全新肾单位的能力,这一根本性缺陷致使人类肾脏病高发且难以逆转[2]。因此,鉴定能够在成体肾脏中再生肾单位的肾脏干细胞(Renal Stem Cells, RSCs),被视为突破现有治疗瓶颈的重要策略。然而,RSCs的分子身份及其生物学特征迄今尚未明确,已成为该领域长期悬而未决的科学难题。
2025年8月22日,陆军军医大学刘赤研究员团队在Science Advances在线发表题为“Identification of Renal Stem Cells in Zebrafish”的研究论文。研究以斑马鱼为模型,整合单细胞转录组测序、光转换谱系追踪及连续干细胞移植等技术,首次鉴定并表征了一群由eya2、six2a与pax2a特异标记的RSCs。该细胞群通过“分化—增殖—去分化”的循环模式实现更新,其机制显著区别于经典干细胞的自我更新范式[3]。

与人类相比,成年斑马鱼在急性肾损伤后可在两周内迅速重建全部缺失的肾单位[4]。既往研究发现,斑马鱼成体肾脏中散布的lhx1a⁺细胞团经移植可形成新生肾单位[4,5],然而RSCs是否位于这些细胞团中,抑或RSCs为这些细胞团的前体,尚缺乏直接证据;RSCs的来源、分化路径及更新机制亦未阐明。为回答上述问题,作者首先以庆大霉素诱导的斑马鱼肾损伤模型为切入点,对损伤后第4天的成体肾脏进行单细胞转录组测序。结果显示,细胞群15高表达six2a、pax2a、lhx1a等哺乳动物肾脏祖细胞标志。利用由CRISPR/Cas9敲入技术构建的Tg(six2a:eGFP)报告鱼系,作者在成鱼肾脏中观察到两种eGFP⁺细胞:间充质样散在细胞以及聚集而成的细胞团。通过进一步的亚群分析,可以发现细胞群15可以分为两个亚群,亚群一高表达six2a、eya2以及间充质细胞标记基因。亚群二高表达lhx1a、pax8、fgf8a以及上皮细胞标记基因。因此作者推测亚群一为RSCs,而亚群二为RSCs分化而成的细胞团组成细胞。
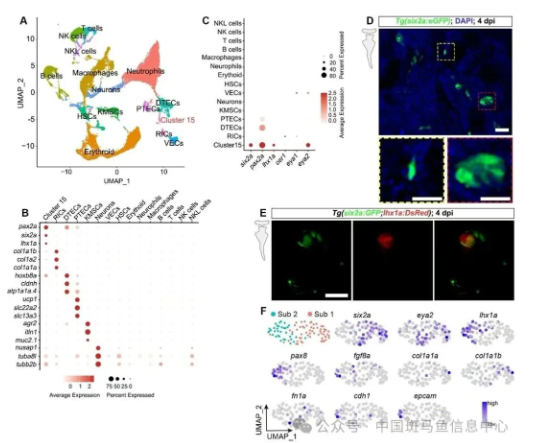
图1:单细胞转录组鉴定RSCs
随后,作者试图以哺乳动物肾脏祖细胞的经典标记osr1、lhx1a、eya1追溯斑马鱼胚胎期RSCs,发现以上报告品系均无法有效标记。转而利用eya1同家族基因eya2,构建Tg(eya2:eGFP)敲入品系。结果显示,胚胎46 hpf (hours post fertilization)时eGFP⁺细胞首先出现于肾小管间;84 hpf起表达Pax2a,继而诱导six2a表达;97 hpf细胞体积增大并伸出伪足,迁移至肾小管上方约20 μm处,形成成熟的RSCs。
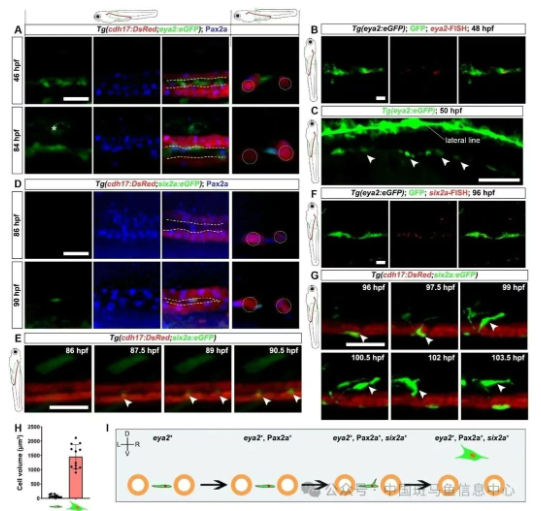
图2:RSCs的产生过程
对幼鱼进行连续追踪发现,与既往报道一致[5],出生后第8天这些细胞开始表达lhx1a并聚集成细胞团,进而增殖并分化出完整肾单位。EdU标记证实,游离的单个RSCs处于增殖静止状态,而成团细胞则呈现显著增殖信号。为解析RSCs更新过程,作者在Tg(six2a:Kaede)品系中利用光转换谱系追踪技术,标记单个细胞团后发现其不仅能生成一个完整肾单位,还可产生4–5个新生RSCs。免疫荧光与原位杂交进一步揭示,RSCs聚集成团时经历间充质–上皮转化(MET)后建立细胞连接;位于团基部的细胞高表达lhx1a并分化为肾单位,而顶部细胞重新激活eya2与six2a,随后脱离细胞团、恢复间充质特征(EMT),完成去分化并生成新的RSCs。
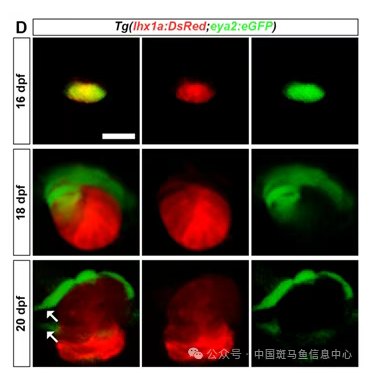
图3:RSCs的更新过程
在未损伤成体肾脏中,发现大量细胞团(约12个细胞)为eya2⁻且长期处于静息状态。肾损伤后,细胞团中部分细胞迅速激活eya2并依次表达six2a、lhx1a,重现胚胎发育程序并生成新的肾单位。连续移植实验证实,six2a⁺/lhx1a⁻/cdh17⁻的RSCs可在体内持续自我更新并产生肾单位。在eya2突变体中,RSCs的更新显著减弱但未完全丧失;而eya1在其中发挥部分遗传代偿作用,但无法完全恢复更新功能,提示斑马鱼RSCs与哺乳动物肾脏祖细胞在调控机制上存在差异[6]。机制层面,免疫共沉淀实验显示Eya2通过与Six1b形成复合物发挥功能。既往研究表明Six1能通过激活Pax2 和Six2 的表达调控哺乳动物肾脏祖细胞发育[7]。同时,Wnt信号在肾脏发育和再生中发挥关键作用[8]。研究发现,过度激活或完全抑制Wnt信号均会阻断RSCs的更新。进一步实验证实,Wnt 信号的下游因子Lef1可直接结合eya2启动子并激活其转录,从而调控 RSCs 的更新。
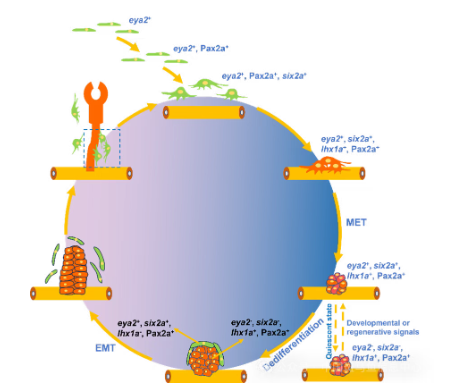
图4:RSCs更新机制图
综上,该研究首次在斑马鱼中鉴定由eya2、pax2a及six2a标记的RSCs,并阐明其“分化–增殖–去分化”的更新模式。这一发现不仅明确了RSCs的产生与更新的细胞生物学机制,也为在体外诱导人类肾脏干细胞并实现肾病治疗奠定了理论与技术基础。研究受国家重点研发计划“干细胞及转化研究”青年科学家项目(项目负责人刘赤)及国家自然科学基金面上项目等资助。文中构建的Tg(six2a:eGFP)和Tg(eya2:eGFP)两个基因敲入品系,即将通过国家水生生物种质资源库国家斑马鱼资源中心对外提供。
参考文献
1.P. Romagnani, G. Remuzzi, R. Glassock, A. Levin, K. J. Jager, M. Tonelli, Z. Massy, C. Wanner, H. J. Anders, Chronic kidney disease. Nat Rev Dis Primers 3, 17088 (2017).
2.Ronco C, Levin A, Warnock DG, Mehta R, Kellum JA, Shah S, et al. Improving outcomes from acute kidney injury (AKI): Report on an initiative. Int J Artif Organs 2007, 30(5): 373-376.
3.Yu T, Liu X, Tan X, Zhang Y, He Z, Yang W, Tian T, Li Y, Zhao J, Liu C. Identification of renal stem Cells in zebrafish. Sci Adv 2025, 10.1126/sciadv.adx5296.
4.Kamei CN, Liu Y, Drummond IA. Kidney Regeneration in Adult Zebrafish by Gentamicin Induced Injury. J Vis Exp 2015(102): e51912.
5.Diep CQ, Ma D, Deo RC, Holm TM, Naylor RW, Arora N, et al. Identification of adult nephron progenitors capable of kidney regeneration in zebrafish. Nature 2011, 470(7332): 95-100.
6.J. Li, C. Cheng, J. Xu, T. Zhang, B. Tokat, G. Dolios, A. Ramakrishnan, L. Shen, R. Wang, P. X. Xu, The transcriptional coactivator Eya1 exerts transcriptional repressive activity by interacting with REST corepressors and REST-binding sequences to maintain nephron progenitor identity. Nucleic Acids Res 50, 10343-10359 (2022).
7.P. X. Xu, W. Zheng, L. Huang, P. Maire, C. Laclef, D. Silvius, Six1 is required for the early organogenesis of mammalian kidney. Development 130, 3085-3094 (2003).
8.D. M. Iglesias, P. A. Hueber, L. Chu, R. Campbell, A. M. Patenaude, A. J. Dziarmaga, J. Quinlan, O. Mohamed, D. Dufort, P. R. Goodyer, Canonical WNT signaling during kidney development. Am J Physiol Renal Physiol 293, F494-500 (2007).






