在人类与癌症的漫长斗争中,免疫治疗的出现无疑是一场革命。它不再直接攻击癌细胞,而是“松开”我们体内免疫系统(特别是T细胞)的“刹车”,让它们能够识别并摧毁癌细胞。然而,现有的免疫疗法,如PD-1/PD-L1抑制剂,仍面临响应率有限、耐药性以及副作用等挑战。如今,一种来自骆驼、羊驼及鲨鱼等特殊动物体内的“纳米抗体”,正以其独特的微型化优势,为这场革命注入新的活力,有望将癌症免疫治疗推向一个更精准、更强大的未来。
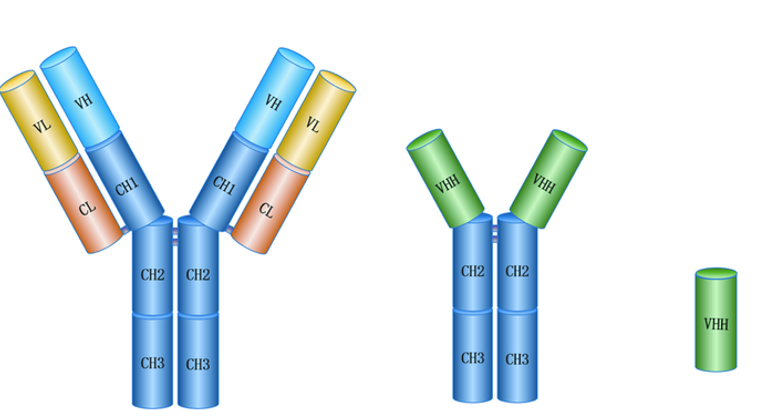
图1:传统抗体、重链抗体与纳米抗体结构对比示意图
纳米抗体的结构与传统抗体有很大的区别。图1中左侧为传统IgG抗体的“Y”形结构,中间为重链抗体,右侧则为纳米抗体1。想象一下,传统抗体就像一个巨大的“Y”形结构,是人体免疫系统的“主力军”。而纳米抗体,却是科学家在骆驼、羊驼和鲨鱼体内发现的,一种天然缺失轻链、仅由重链可变区构成的抗体片段。它们的大小只有传统抗体的十分之一,是已知最小的、天然存在的、具备完整抗原结合功能的片段。正是这种微型化结构,赋予了纳米抗体一系列令人瞩目的优势:(1)体积小,穿透力强:纳米抗体能轻松穿透实体瘤致密的组织屏障,到达传统抗体难以触及的靶点,实现更有效的肿瘤杀伤。(2)稳定性高,易于生产:它们对高温、极端pH值具有强大的耐受性,且可以大规模、低成本生产。(3)高亲和力与特异性:尽管结构简单,但其互补决定区(CDR3)更长,能深入结合传统抗体无法触及的抗原表位,实现精准靶向。(4)低免疫原性:经过人源化改造后,其在人体内引发免疫排斥的风险较低。(5)其基于单链抗体的特性,赋予了它卓越的“可编程性”:纳米抗体可以轻松与其他功能模块串联2,易于开发双特异性抗体、ADC偶联药物以及CAR-T细胞疗法。因此,纳米抗体在疾病诊断、治疗和药物研发领域具有广泛应用前景。
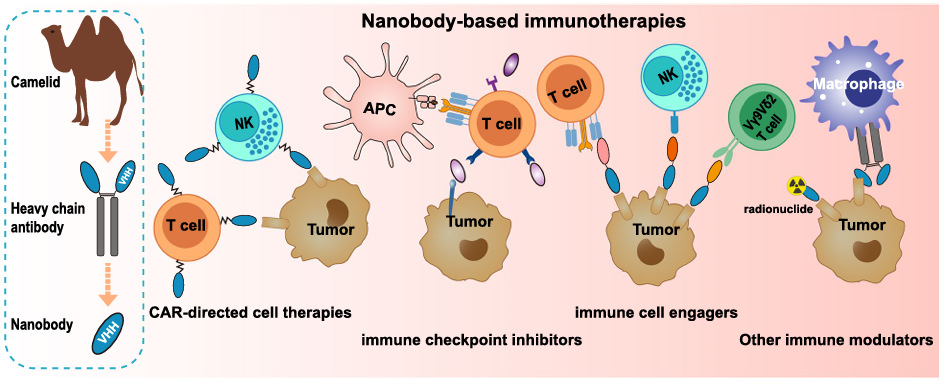
图2:基于纳米抗体的免疫疗法示意图3
纳米抗体正从多个维度开拓癌症免疫治疗的未来,主要应用在以下三大方向,如图2所示示意图:
(1)打造“双特异性”T细胞衔接器——为T细胞装上“GPS”:癌细胞之所以能逃避免疫追杀,常常是因为T细胞无法有效识别它。双特异性T细胞衔接器就像一个“连接器”,一端结合T细胞表面的CD3分子,另一端结合肿瘤特异性抗原,将T细胞“强行”牵引到癌细胞周围,并激活其杀伤功能3。
(2)武装CAR-T细胞——打造更安全、更智能的“活体药物”:CAR-T细胞疗法在血液肿瘤中取得了巨大成功,但在实体瘤中举步维艰,部分原因是实体瘤微环境(TME)的抑制以及靶向非肿瘤组织的“脱靶毒性”。纳米抗体可以作为CAR-T细胞的“识别臂”(抗原结合域)。正是其小巧的体积,可能有助于CAR-T细胞更好地浸润致密的实体瘤组织4。
(3)调节肿瘤微环境——逆转“冷”肿瘤为“热”肿瘤:许多肿瘤是“冷肿瘤”,意味着其内部充满了抑制性的免疫细胞(如调节性T细胞等),而缺乏杀伤性T细胞。纳米抗体可以像“微型开关”一样,精准调控肿瘤微环境,如开发靶向PD-1、CTLA-4等经典免疫检查点的纳米抗体5。
尽管前景广阔,纳米抗体的发展仍面临挑战。其较小的尺寸可能导致在血液中被快速清除,但通过聚乙二醇化或融合白蛋白结合域等技术,可以有效延长其半衰期6。此外,对其长期安全性和免疫原性的评估仍需更多临床数据。
纳米抗体,这把来自大自然的“微型手术刀”,正以其精准、灵活和强大的可编程能力,有力地切入癌症免疫治疗的瓶颈领域。它不仅是工具的创新,更是治疗理念的革新——让我们能够以前所未有的精度去设计和操控免疫反应。我们有理由相信,在不久的将来,这些微小的分子将在对抗癌症的宏大战役中,扮演举足轻重的角色,为无数患者带来新的希望。
参考文献:
[1] Salvador J-P, Vilaplana L, Marco M-P.Nanobody: outstanding features for diagnostic and therapeutic applications[J].Analytical and bioanalytical chemistry,2019, 411 (9): 1703-1713.
[2] Wang W, Hu Y, Li B, Wang H, Shen J. Applications of nanobodies in the prevention, detection, and treatment of the evolving SARS-CoV-2. Biochem Pharmacol. 2023;208:115401.
[3] Yang, Xm., Lin, Xd., Shi, W. et al. Nanobody-based bispecific T-cell engager (Nb-BiTE): a new platform for enhanced T-cell immunotherapy. Sig Transduct Target Ther 8, 328 (2023).
[4] Li H, Zhou Q, Cao N, et al. Nanobodies and their derivatives: pioneering the future of cancer immunotherapy. Cell Commun Signal. 2025;23(1):271.
[5] Xian Z, Ma L, Zhu M, et al. Blocking the PD-1-PD-L1 axis by a novel PD-1 specific nanobody expressed in yeast as a potential therapeutic for immunotherapy. Biochem Biophys Res Commun. 2019;519(2):267-273.
[6] Van Audenhove I, Gettemans J. Nanobodies as Versatile Tools to Understand, Diagnose, Visualize and Treat Cancer. EBioMedicine. 2016;8:40-48.