跨物种免疫不相容阻碍了猪到人的异种移植,但猪基因组工程最近使第一次成功的实验成为可能。然而,对猪肾移植给人类受体后的免疫反应知之甚少。2023年8月17日,法国巴黎城市大学Alexandre Loupy团队在Lancet(IF=169)在线发表题为“Immune response after pig-to-human kidney xenotransplantation: a multimodal phenotyping study”的研究论文,该研究使用多模态深度表型方法精确描述了异种移植的早期免疫反应。从异种移植物收集的数据表明抗体介导的排斥反应的早期迹象,其特征是微血管炎症伴免疫沉积、内皮细胞活化和阳性异种反应交叉匹配。毛细血管炎症主要由血管内CD68+和CD15+先天免疫细胞以及NKp46+细胞组成。两种异种移植物都显示出与体液反应相关的基因的生物学表达增加,包括单核细胞和巨噬细胞活化、自然杀伤细胞负荷、内皮细胞活化、补体活化和T细胞发育。全转录组数字空间分析显示,抗体介导的损伤主要位于异种移植物的肾小球,与单核细胞、巨噬细胞、中性粒细胞和自然杀伤细胞相关的转录物显著富集。这种表型在对照猪自体肾移植或缺血再灌注模型中未观察到。尽管短期预后良好且无超急性损伤,但研究结果表明,猪-人异种肾移植可能会发生抗体介导的排斥反应。该研究结果提出了针对体液排斥反应的特定治疗靶点,以改善异种移植的结果。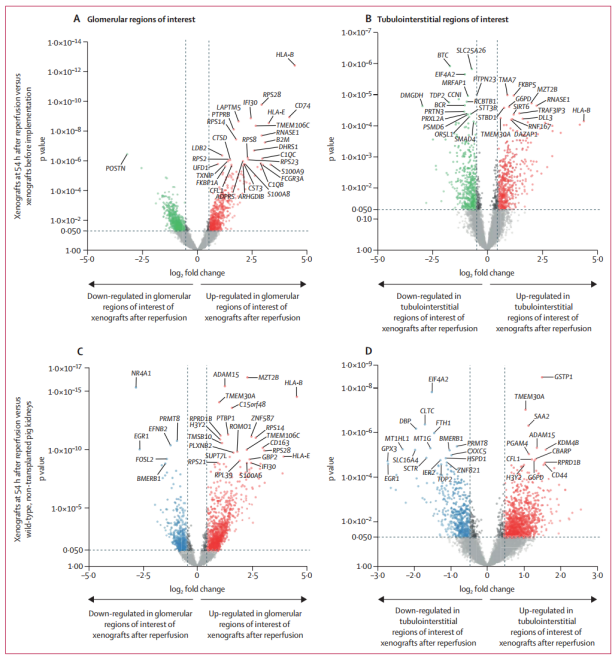 转基因猪肾异种移植的转录和免疫景观(图源自Lancet)这种移植到脑死亡人类受体的转基因猪肾异种移植的多模态深度表型显示了一种早期抗体介导的排斥模式,循环异种抗体和免疫沉积,与IFNγ反应、单核细胞和巨噬细胞激活、自然杀伤负担和内皮细胞激活相关的基因表达增加证实了这一点。这种表型主要发生在异种移植物的肾小球中,主要与单核细胞、巨噬细胞、中性粒细胞和自然杀伤细胞的参与有关。该研究证实,去除半乳糖-1,3-半乳糖碳水化合物表位可以保护猪内皮细胞免受超急性排斥反应和补体诱导的裂解,解决了这一先前已知的异种免疫问题。然而,值得注意的是,尽管有这种保护作用,但研究结果表明,并非所有潜在的异种免疫相关损伤都得到了完全解决。两种异种移植物均表现出抗体介导的排斥反应:肾小球和小管周围毛细血管中存在血管内白细胞;当前或近期抗体与血管内皮相互作用的证据,特征为微血管炎症和与抗体介导的排斥反应相关的基因表达增加;血清学证据表明,在两个受体中循环供体特异性抗体(即针对非半乳糖- α -1,3-半乳糖抗原的异种抗体)。这些惰性形式(两种异种移植物都产生了尿液并恢复了肾功能)在免疫组织化学中没有显示C4d沉积的证据,这表明它们是由其他生物途径驱动的,而不是补体级联的激活先前对非人类灵长类动物的研究为猪肾异种移植后的免疫反应提供了有价值的见解,但灵长类动物与人类之间的内在差异需要对人类进行研究。总之,结合多维空间分子评估、异种移植活检的广泛表型分析和循环异种抗体的特征,作者提供了转基因猪肾移植到人类受体中抗体介导的积极排斥反应的证据。这种模式主要发生在异种移植物的肾小球中,主要与单核细胞和巨噬细胞活化、自然杀伤细胞负荷、IFNγ反应和内皮细胞活化有关。这些结果为完善下一代猪基因编辑和优化异种移植临床试验中体液排斥臂的控制开辟了途径和研究方向。
转基因猪肾异种移植的转录和免疫景观(图源自Lancet)这种移植到脑死亡人类受体的转基因猪肾异种移植的多模态深度表型显示了一种早期抗体介导的排斥模式,循环异种抗体和免疫沉积,与IFNγ反应、单核细胞和巨噬细胞激活、自然杀伤负担和内皮细胞激活相关的基因表达增加证实了这一点。这种表型主要发生在异种移植物的肾小球中,主要与单核细胞、巨噬细胞、中性粒细胞和自然杀伤细胞的参与有关。该研究证实,去除半乳糖-1,3-半乳糖碳水化合物表位可以保护猪内皮细胞免受超急性排斥反应和补体诱导的裂解,解决了这一先前已知的异种免疫问题。然而,值得注意的是,尽管有这种保护作用,但研究结果表明,并非所有潜在的异种免疫相关损伤都得到了完全解决。两种异种移植物均表现出抗体介导的排斥反应:肾小球和小管周围毛细血管中存在血管内白细胞;当前或近期抗体与血管内皮相互作用的证据,特征为微血管炎症和与抗体介导的排斥反应相关的基因表达增加;血清学证据表明,在两个受体中循环供体特异性抗体(即针对非半乳糖- α -1,3-半乳糖抗原的异种抗体)。这些惰性形式(两种异种移植物都产生了尿液并恢复了肾功能)在免疫组织化学中没有显示C4d沉积的证据,这表明它们是由其他生物途径驱动的,而不是补体级联的激活先前对非人类灵长类动物的研究为猪肾异种移植后的免疫反应提供了有价值的见解,但灵长类动物与人类之间的内在差异需要对人类进行研究。总之,结合多维空间分子评估、异种移植活检的广泛表型分析和循环异种抗体的特征,作者提供了转基因猪肾移植到人类受体中抗体介导的积极排斥反应的证据。这种模式主要发生在异种移植物的肾小球中,主要与单核细胞和巨噬细胞活化、自然杀伤细胞负荷、IFNγ反应和内皮细胞活化有关。这些结果为完善下一代猪基因编辑和优化异种移植临床试验中体液排斥臂的控制开辟了途径和研究方向。

 转基因猪肾异种移植的转录和免疫景观(图源自Lancet)这种移植到脑死亡人类受体的转基因猪肾异种移植的多模态深度表型显示了一种早期抗体介导的排斥模式,循环异种抗体和免疫沉积,与IFNγ反应、单核细胞和巨噬细胞激活、自然杀伤负担和内皮细胞激活相关的基因表达增加证实了这一点。这种表型主要发生在异种移植物的肾小球中,主要与单核细胞、巨噬细胞、中性粒细胞和自然杀伤细胞的参与有关。该研究证实,去除半乳糖-1,3-半乳糖碳水化合物表位可以保护猪内皮细胞免受超急性排斥反应和补体诱导的裂解,解决了这一先前已知的异种免疫问题。然而,值得注意的是,尽管有这种保护作用,但研究结果表明,并非所有潜在的异种免疫相关损伤都得到了完全解决。两种异种移植物均表现出抗体介导的排斥反应:肾小球和小管周围毛细血管中存在血管内白细胞;当前或近期抗体与血管内皮相互作用的证据,特征为微血管炎症和与抗体介导的排斥反应相关的基因表达增加;血清学证据表明,在两个受体中循环供体特异性抗体(即针对非半乳糖- α -1,3-半乳糖抗原的异种抗体)。这些惰性形式(两种异种移植物都产生了尿液并恢复了肾功能)在免疫组织化学中没有显示C4d沉积的证据,这表明它们是由其他生物途径驱动的,而不是补体级联的激活先前对非人类灵长类动物的研究为猪肾异种移植后的免疫反应提供了有价值的见解,但灵长类动物与人类之间的内在差异需要对人类进行研究。总之,结合多维空间分子评估、异种移植活检的广泛表型分析和循环异种抗体的特征,作者提供了转基因猪肾移植到人类受体中抗体介导的积极排斥反应的证据。这种模式主要发生在异种移植物的肾小球中,主要与单核细胞和巨噬细胞活化、自然杀伤细胞负荷、IFNγ反应和内皮细胞活化有关。这些结果为完善下一代猪基因编辑和优化异种移植临床试验中体液排斥臂的控制开辟了途径和研究方向。
转基因猪肾异种移植的转录和免疫景观(图源自Lancet)这种移植到脑死亡人类受体的转基因猪肾异种移植的多模态深度表型显示了一种早期抗体介导的排斥模式,循环异种抗体和免疫沉积,与IFNγ反应、单核细胞和巨噬细胞激活、自然杀伤负担和内皮细胞激活相关的基因表达增加证实了这一点。这种表型主要发生在异种移植物的肾小球中,主要与单核细胞、巨噬细胞、中性粒细胞和自然杀伤细胞的参与有关。该研究证实,去除半乳糖-1,3-半乳糖碳水化合物表位可以保护猪内皮细胞免受超急性排斥反应和补体诱导的裂解,解决了这一先前已知的异种免疫问题。然而,值得注意的是,尽管有这种保护作用,但研究结果表明,并非所有潜在的异种免疫相关损伤都得到了完全解决。两种异种移植物均表现出抗体介导的排斥反应:肾小球和小管周围毛细血管中存在血管内白细胞;当前或近期抗体与血管内皮相互作用的证据,特征为微血管炎症和与抗体介导的排斥反应相关的基因表达增加;血清学证据表明,在两个受体中循环供体特异性抗体(即针对非半乳糖- α -1,3-半乳糖抗原的异种抗体)。这些惰性形式(两种异种移植物都产生了尿液并恢复了肾功能)在免疫组织化学中没有显示C4d沉积的证据,这表明它们是由其他生物途径驱动的,而不是补体级联的激活先前对非人类灵长类动物的研究为猪肾异种移植后的免疫反应提供了有价值的见解,但灵长类动物与人类之间的内在差异需要对人类进行研究。总之,结合多维空间分子评估、异种移植活检的广泛表型分析和循环异种抗体的特征,作者提供了转基因猪肾移植到人类受体中抗体介导的积极排斥反应的证据。这种模式主要发生在异种移植物的肾小球中,主要与单核细胞和巨噬细胞活化、自然杀伤细胞负荷、IFNγ反应和内皮细胞活化有关。这些结果为完善下一代猪基因编辑和优化异种移植临床试验中体液排斥臂的控制开辟了途径和研究方向。





