
北京时间10月7日17:30, 2019年诺贝尔生理学或医学奖在瑞典卡洛琳斯卡学院(Karolinska Institute)揭晓,来自哈佛医学院的威廉·凯林(William G. Kaelin Jr)、牛津大学的彼得·拉特克利夫(Sir Peter J. Ratcliffe)和约翰霍普金斯大学的格雷格·塞门扎(Gregg L. Semenza)共同分享了这一奖项,以表彰他们发现“细胞如何感知和适应氧气可用性”方面的贡献。值得一提的是,他们三位也因该贡献一起分享了2016年的拉斯克奖。

众所周知,氧气约占地球大气层1/5,是地球上的动物赖以生存的必需元素。动物的一切生命活动都需要能量,能量的最主要来源是食物,而氧气则是细胞将食物营养成分转化为能量不可或缺的条件,动物细胞内的线粒体通过氧化呼吸链生成能量(1931年诺贝尔生理学或医学奖)。
历经数亿年的进化,动物早已能够适应氧气含量变化。20世纪初,Paul Carnot和其他科学家发现红细胞生成素(Erythropoietin,EPO)能够促进红细胞生成,而低氧条件能诱导EPO水平升高[1]。随后,1938年诺贝尔生理学或医学奖得主柯奈尔·海门斯(Corneille Heymans)发现颈动脉体能够感知血氧浓度,进而影响神经系统,调节呼吸频率[2]。
但是,氧气本身是如何参与这些调节的,仍然是未解之谜。直到20世纪末,William Kaelin, Jr、Gregg Semenza及Sir Peter Ratcliffe三位科学家的工作解开了这个谜团。Gregg Semenza及Sir Peter Ratcliffe发现人类EPO基因附近有特殊的DNA片段能够对缺氧(Hypoxia)产生响应,并且在不同的细胞类型中均存在这一机制。通过进一步研究,Semenza找到了结合上述DNA片段的蛋白,命名为缺氧诱导因子(Hypoxia-Inducible Factors,HIF),并阐明了HIF是由两个转录因子HIF-1α及 ARNT组成的复合物,且HIF以氧浓度依赖的方式与目标DNA片段结合[3, 4]。在正常氧气水平下,细胞中的HIF-1α含量极低,HIF-1α合成后会经泛素化途径被快速降解(2004 年诺贝尔化学奖)。然而,当细胞处于缺氧条件时,HIF-1α就会在细胞中累积,结合到EPO基因(及其他HIF诱导基因)附近的DNA元件上,启动目的基因转录。至此,氧感知通路已经初步展示在我们眼前!但是,为什么低氧条件能够导致HIF-1α累积?氧气在这个过程中扮演了什么角色?答案来自一个比较意外的研究方向。当Semenza 和Ratcliffe 在研究EPO基因的转录调控时,肿瘤学家William Kaelin, Jr.正在研究一种由VHL基因突变引起的遗传病von Hippel-Lindau’s disease (VHL disease),该疾病可导致特定肿瘤发生率增加。他意外地发现,当VHL基因功能缺失时一些低氧诱导的基因表达却异常升高,而回补功能正常的VHL基因可以逆转这一现象[5]。由此,推断VHL与低氧响应相关。最终通过实验证实,VHL与HIF-1α结合是导致HIF-1α降解的必要条件!由此建立了VHL与HIF-1α之间的联系。VHL的加入,使得氧感知通路拼图趋于完整,但尚不能回答氧气是如何影响HIF-1α的降解过程的。Ratcliffe等在2001年发表的两篇文章回答了这个问题:氧气含量正常时,HIF-1α的两个特定位置会被HIF-PH羟基化,此时VHL便识别并结合HIF-1α,诱导其经泛素化途径降解[5, 6]。当氧气不足时,羟基化不能正常发生,HIF-1α得以保留并进入细胞核结合目标DNA行使其转录因子的功能(图二)。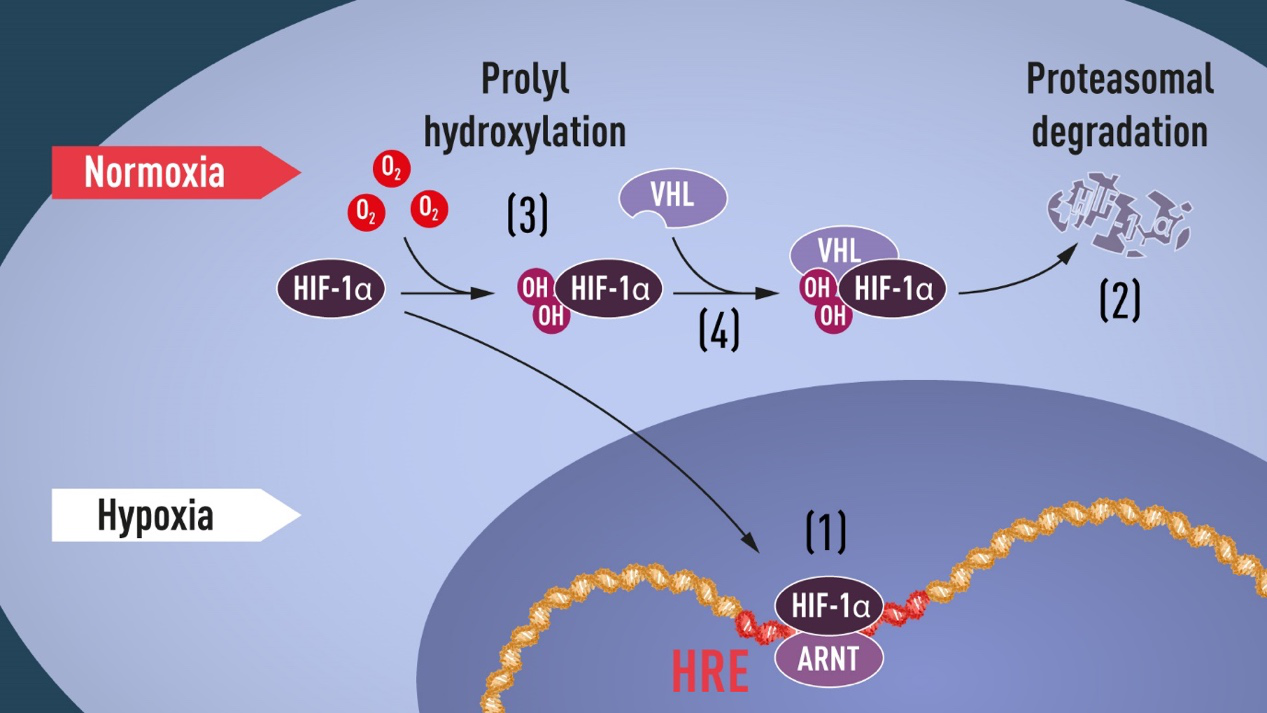
图二 氧感知通路示意图
图片来源:The Nobel Prize in Physiology or Medicine 2019. NobelPrize.org. Nobel Media AB 2019. Tue. 8 Oct 2019.
至此,三位科学家的工作阐明了氧感知通路及其背后的分子机制。前面我们已经提到,氧气是地球上的动物将食物转化为能量的必需条件,搞清楚动物机体/细胞是如何感知缺氧条件并作出相应的适应性响应,对于理解生理和病理过程非常重要。借助Micro Array及ChIP研究,我们已经知道,在缺氧条件下HIF可以诱导1000余个基因的表达(图三)[7-9]。HIF诱导基因主要分为两类:一类负责增加氧气含量,例如促进红细胞生成的EPO,促进血管形成的VEGF;另一类负责降低氧气消耗,例如促进糖酵解的LHDA及丙酮酸脱氢酶。此外,对氧感知通路的进一步研究也发现了以HIF为中心的上下游信号通路(图四)。HIF通路中的这些基因大部分都是正常生理过程的关键构件(如信号通路中的激酶、受体等),参与细胞增殖、存活、迁移、代谢、干性维持、血管生成、免疫逃逸等过程,它们的功能异常与多种疾病密切相关,这些基因也可作为治疗相关疾病的潜在靶点。
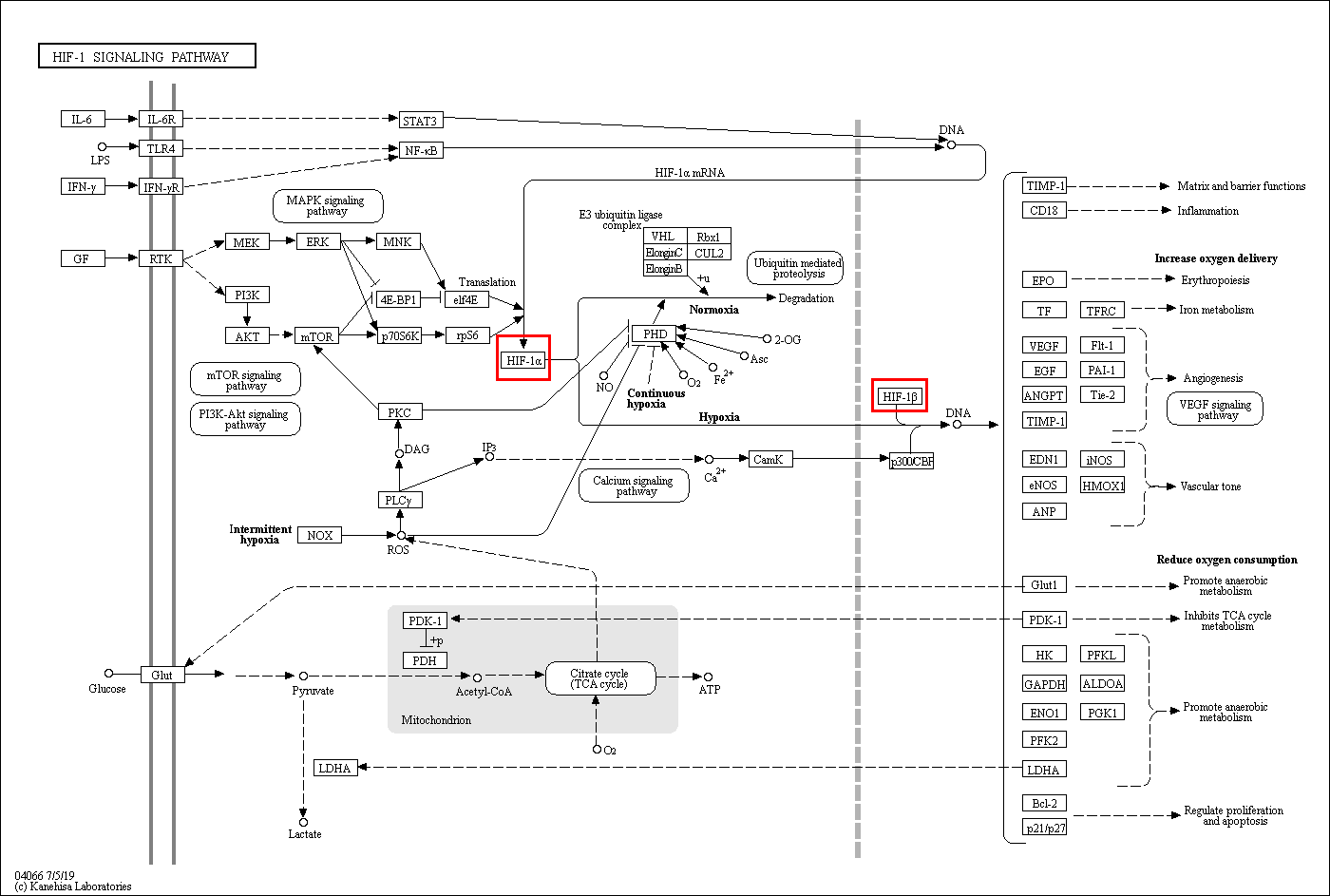
图片来源:KEGG, HIF-1 signaling pathway.
事实上,基于三位科学家的开创性发现,已经有多个靶向HIF通路的药物获批上市或立项研发。例如,贫血会导致机体缺氧,造成生活质量下降甚至死亡,HIF通路的发现揭示了一个全新的治疗方向——激活HIF通路可促进EPO、VEGF等基因表达,促进红细胞或血管生成,以增加氧气摄入的方式来治疗贫血。HIF-PH是HIF-1α羟基化的关键酶,目前已经有多个HIF-PH抑制剂在研发中,2018年12月获得中国NMPA批准的1类创新药罗沙司他(roxadustat,研发代码:FG-4592),就是用于治疗因慢性肾脏病(CKD)引起的贫血的HIF-PH抑制剂[11]。

图五HIF-PH抑制剂的作用原理[12]
图片来源:Gupta, N. and J.B. Wish, Hypoxia-Inducible Factor Prolyl Hydroxylase Inhibitors: A Potential New Treatment for Anemia in Patients With CKD. Am J Kidney Dis, 2017. 69(6): p. 815-826.
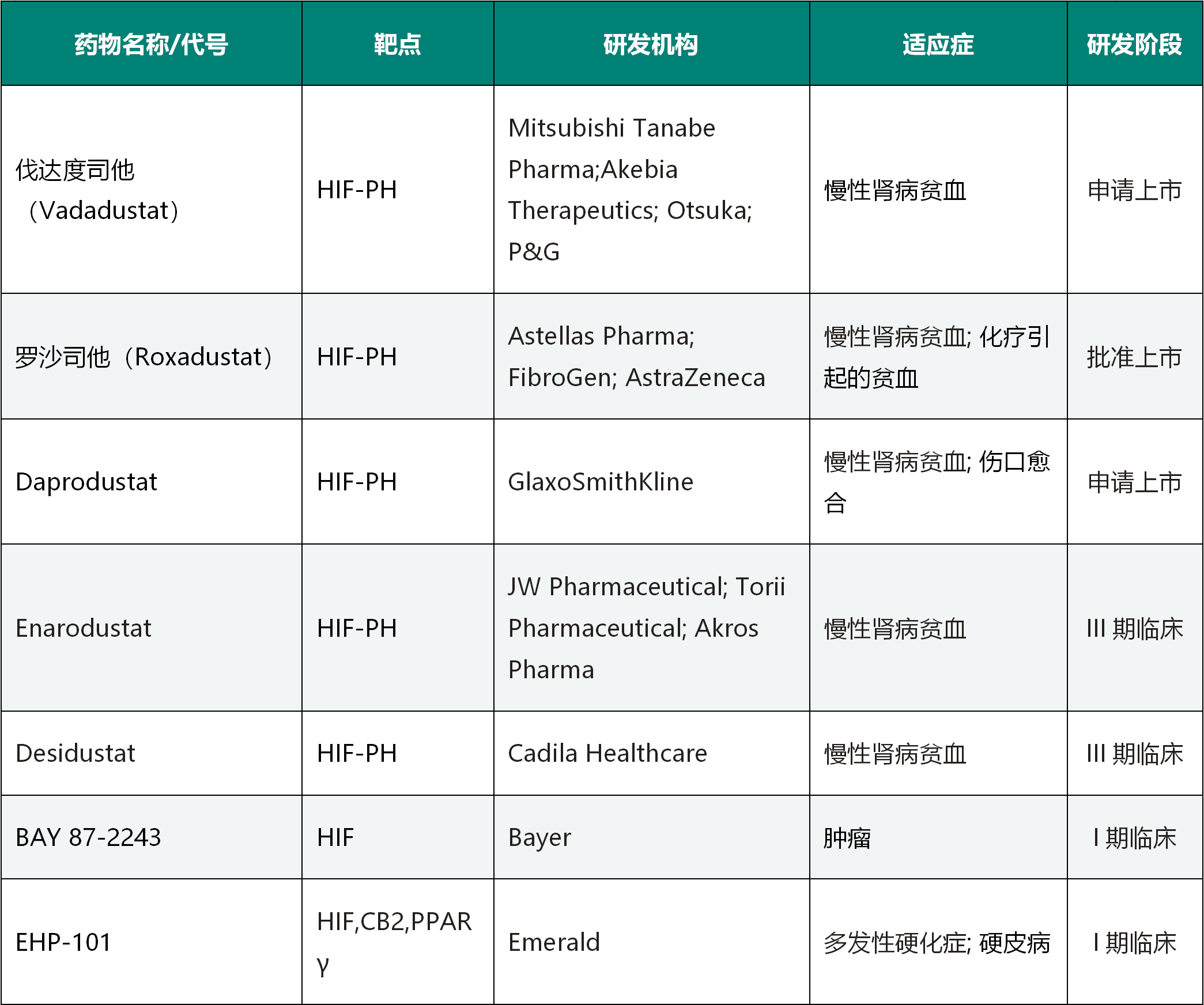
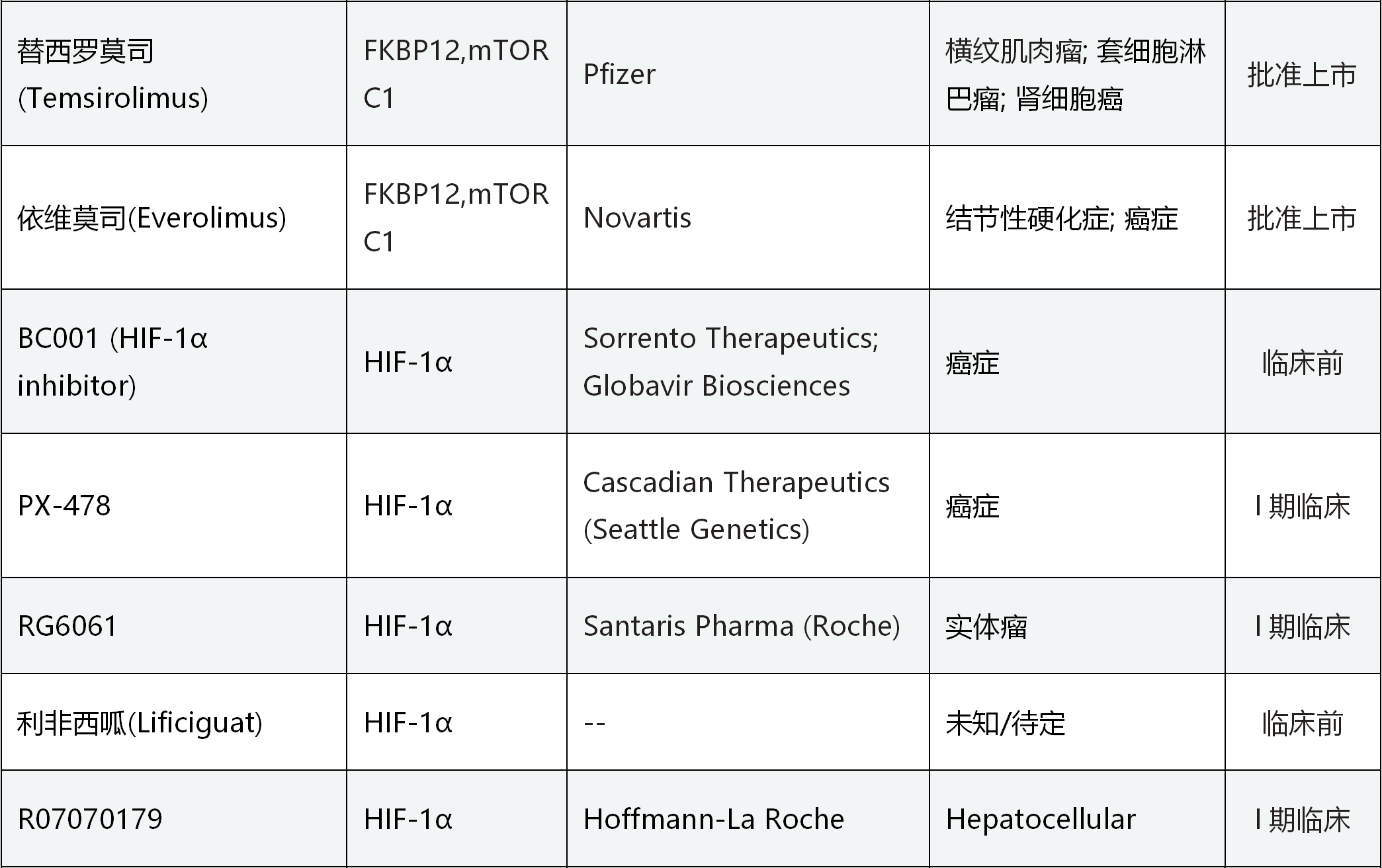
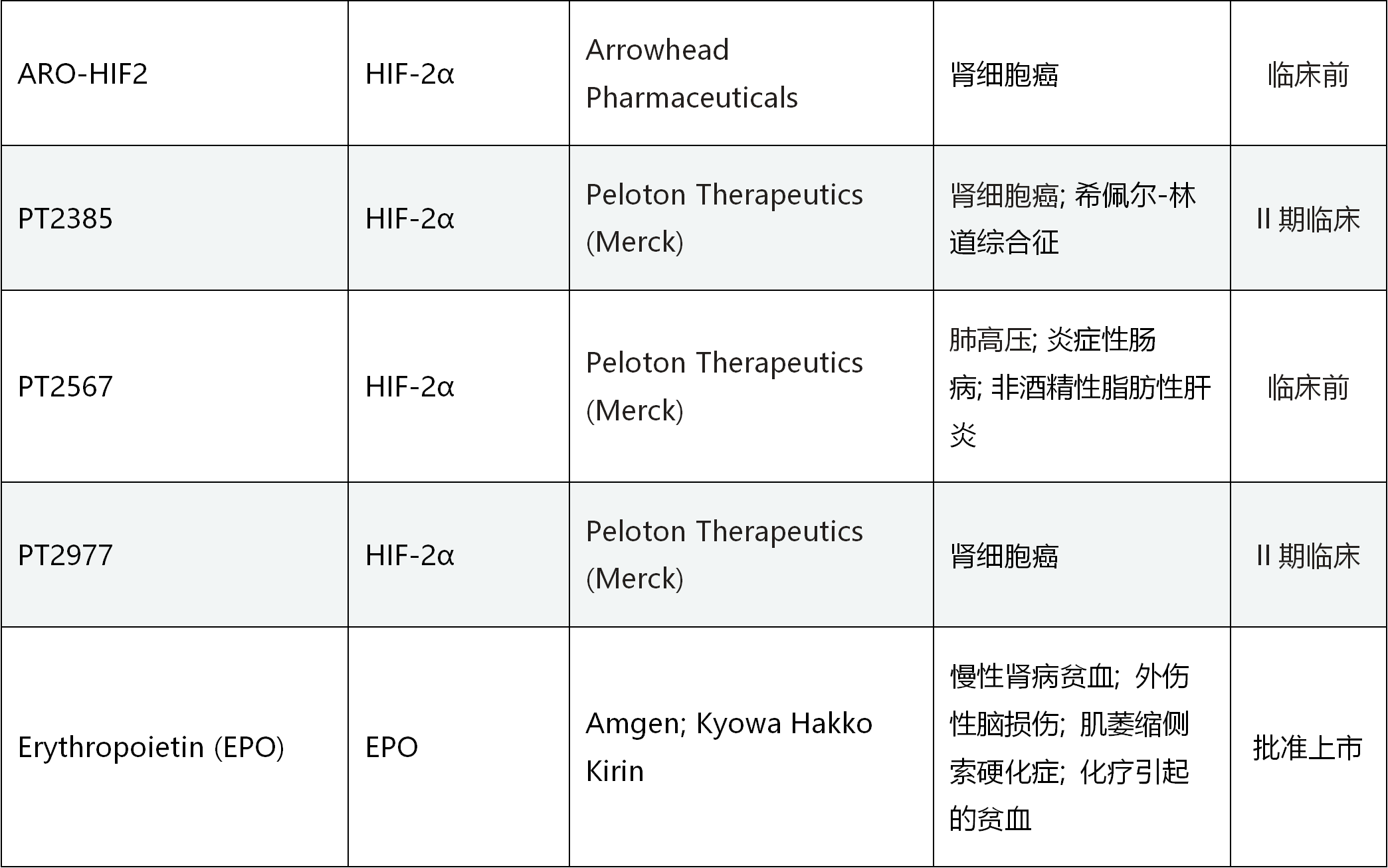
此外,许多实体肿瘤内部也是缺氧环境,HIF通路高度活化,诱导促进血管生成、肿瘤细胞增殖及免疫抑制的多个基因表达水平升高,增加肿瘤细胞的增殖、逃逸和转移。与治疗贫血的思路相反,通过抑制HIF通路,避免HIF诱导基因的激活,就可以阻止肿瘤细胞增殖、存活和迁移,从而治疗肿瘤。多个靶向HIF及其上下游蛋白的药物正在火热研发中,如拜耳公司的BAY 87-2243就是以HIF为靶点的选择性抑制剂[13],正在I期临床试验阶段;Peloton Therapeutics公司的PT2977是HIF2α的选择性抑制剂[14],用于治疗肾细胞癌,正在II期临床试验阶段,其临床数据也是令人鼓舞的。表一 部分靶向HIF通路的药效研发进展
数据来源:Clinicaltrial.gov及医药魔方数据库,集萃药康整理。点击查看大图。
除了贫血和肿瘤外,靶向HIF通路的药物还用于治疗多发性硬化症、炎性肠病及肝炎等多种疾病,相关的新药研发也在进行中。我们相信,基于HIF通路,将会有更多的药物和疗法出现,造福更大的病患群体。而William G. Kaelin Jr、Sir Peter J. Ratcliffe和Gregg L. Semenza三位科学家的开创性工作,是这一切的基础,他们获得2019年的诺贝尔奖,实至名归!
当然,HIF通路相关的研究之路还任重道远,许多科学问题等待被回答,许多隐藏的新机制等待被发现。

 参考文献1.Carnot, P.,Sur l’activité hémopoiétique du sérum au cours de la régénération du sang.Comptes rendus de l'Académie des Sciences 1906.143: p. 384-386.2.Bouckaert, J.J. and C. Heymans,Carotid sinus reflexes. Influence of central blood-pressure and blood supply on respiratory and vaso-motor centres.J Physiol, 1933.79(1): p. 49-66.3.Wang, G.L., et al.,Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension.Proc Natl Acad Sci U S A, 1995.92(12): p. 5510-4.4.Semenza, G.L., et al.,Hypoxia-inducible nuclear factors bind to an enhancer element located 3' to the human erythropoietin gene.Proc Natl Acad Sci U S A, 1991.88(13): p. 5680-4.5.Ivan, M., et al.,HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing.Science, 2001.292(5516): p. 464-8.6.Jaakkola, P., et al.,Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation.Science, 2001.292(5516): p. 468-72.7.Schodel, J., et al.,High-resolution genome-wide mapping of HIF-binding sites by ChIP-seq.Blood, 2011.117(23): p. e207-17.8.Xia, X., et al.,Integrative analysis of HIF binding and transactivation reveals its role in maintaining histone methylation homeostasis.Proc Natl Acad Sci U S A, 2009.106(11): p. 4260-5.9.Manalo, D.J., et al.,Transcriptional regulation of vascular endothelial cell responses to hypoxia by HIF-1.Blood, 2005.105(2): p. 659-69.10.Dengler, V.L., M. Galbraith, and J.M. Espinosa,Transcriptional regulation by hypoxia inducible factors.Crit Rev Biochem Mol Biol, 2014.49(1): p. 1-15.11.Chen, N., et al.,Roxadustat for Anemia in Patients with Kidney Disease Not Receiving Dialysis.N Engl J Med, 2019.381(11): p. 1001-1010.12.Gupta, N. and J.B. Wish,Hypoxia-Inducible Factor Prolyl Hydroxylase Inhibitors: A Potential New Treatment for Anemia in Patients With CKD.Am J Kidney Dis, 2017.69(6): p. 815-826.13.Ellinghaus, P., et al.,BAY 87-2243, a highly potent and selective inhibitor of hypoxia-induced gene activation has antitumor activities by inhibition of mitochondrial complex I.Cancer Med, 2013.2(5): p. 611-24.14.Wallace, E.M., et al.,A Small-Molecule Antagonist of HIF2alpha Is Efficacious in Preclinical Models of Renal Cell Carcinoma.Cancer Res, 2016.76(18): p. 5491-500.
参考文献1.Carnot, P.,Sur l’activité hémopoiétique du sérum au cours de la régénération du sang.Comptes rendus de l'Académie des Sciences 1906.143: p. 384-386.2.Bouckaert, J.J. and C. Heymans,Carotid sinus reflexes. Influence of central blood-pressure and blood supply on respiratory and vaso-motor centres.J Physiol, 1933.79(1): p. 49-66.3.Wang, G.L., et al.,Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension.Proc Natl Acad Sci U S A, 1995.92(12): p. 5510-4.4.Semenza, G.L., et al.,Hypoxia-inducible nuclear factors bind to an enhancer element located 3' to the human erythropoietin gene.Proc Natl Acad Sci U S A, 1991.88(13): p. 5680-4.5.Ivan, M., et al.,HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing.Science, 2001.292(5516): p. 464-8.6.Jaakkola, P., et al.,Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation.Science, 2001.292(5516): p. 468-72.7.Schodel, J., et al.,High-resolution genome-wide mapping of HIF-binding sites by ChIP-seq.Blood, 2011.117(23): p. e207-17.8.Xia, X., et al.,Integrative analysis of HIF binding and transactivation reveals its role in maintaining histone methylation homeostasis.Proc Natl Acad Sci U S A, 2009.106(11): p. 4260-5.9.Manalo, D.J., et al.,Transcriptional regulation of vascular endothelial cell responses to hypoxia by HIF-1.Blood, 2005.105(2): p. 659-69.10.Dengler, V.L., M. Galbraith, and J.M. Espinosa,Transcriptional regulation by hypoxia inducible factors.Crit Rev Biochem Mol Biol, 2014.49(1): p. 1-15.11.Chen, N., et al.,Roxadustat for Anemia in Patients with Kidney Disease Not Receiving Dialysis.N Engl J Med, 2019.381(11): p. 1001-1010.12.Gupta, N. and J.B. Wish,Hypoxia-Inducible Factor Prolyl Hydroxylase Inhibitors: A Potential New Treatment for Anemia in Patients With CKD.Am J Kidney Dis, 2017.69(6): p. 815-826.13.Ellinghaus, P., et al.,BAY 87-2243, a highly potent and selective inhibitor of hypoxia-induced gene activation has antitumor activities by inhibition of mitochondrial complex I.Cancer Med, 2013.2(5): p. 611-24.14.Wallace, E.M., et al.,A Small-Molecule Antagonist of HIF2alpha Is Efficacious in Preclinical Models of Renal Cell Carcinoma.Cancer Res, 2016.76(18): p. 5491-500.
HIF通路上各个基因的基因修饰小鼠(敲除、条件型敲除),无疑是HIF通路相关研究的重要资源,集萃药康于2018年启动了斑点鼠计划,旨在制作所有蛋白编码基因的flox(条件型敲除)小鼠模型,为基础科研及新药研发企业提供小鼠模型。
目前,该计划已成功建立5000余品系,为方便客户找到自己感兴趣的模型,集萃药康已经推出了以信号通路为基础的可视化搜索(GPT Pathway),让您能够以整个通路的视角去为自己的研究部署资源。哪里要鼠点哪里(点开图片识别二维码跳转链接):

或直接按基因在品系库搜索(点开图片识别二维码跳转链接):

斑点鼠资源库包含HIF通路相关的基因敲除小鼠模型(表二):
表二 集萃药康HIF通路相关基因敲除小鼠模型资源| 模型名称 | 模型类型 |
| Hif1a-KO | Knockout (KO) |
| Hif1a-flox | Conditional knockout(cKO) |
| Epo-flox | Conditional knockout(cKO) |
| Epo-KO | Knockout (KO) |
| Edn1-flox | Conditional knockout(cKO) |
| Hk1-flox | Conditional knockout(cKO) |
| Nos2-flox | Conditional knockout(cKO) |
| Slc2a1-flox | Conditional knockout(cKO) |
| Vegfa-flox | Conditional knockout(cKO) |
| Edn1-KO | Knockout (KO) |
| Hk1-KO | Knockout (KO) |
| Nos2-KO | Knockout (KO) |
| Slc2a1-KO | Knockout (KO) |
| Vegfa-KO | Knockout (KO) |






