2025年1月2日,华东师范大学钟涛教授研究合作团队在Nature Communications期刊在线发表题为“The transcriptional repressor HEY2 regulates mitochondrial oxidative respiration to maintain cardiac homeostasis”的研究论文。该研究应用斑马鱼、小鼠、哺乳动物及人类心肌细胞为模型,发现转录抑制因子HEY2与HDAC1结合,通过组蛋白去乙酰化和染色质可及性重塑,控制能量转录共激活因子及脂肪酸氧化酶的表达,将线粒体氧化呼吸和代谢限制在合理水平,从而实现心脏功能的稳态维持。 该研究首先观察到HEY2蛋白在扩张型心肌病样本中表达升高,提示HEY2高表达与心力衰竭有关联。进一步研究发现,斑马鱼心肌细胞特异性过表达Hey2导致心室扩张,射血分数降低,心室舒张末期内径增加,最终发展为心力衰竭。此外,细胞外基质胶原蛋白和纤连蛋白表达升高,与马松染色和天狼猩红染色显示胶原纤维沉积增加一致。同时,胚胎心肌蛋白亚型与成年心肌亚型表达比值上升,表明hey2心肌过表达导致斑马鱼心脏发生病理重构和心力衰竭。通过透射电镜检测分析,Hey2心肌过表达引起线粒体数目减少、膜和嵴等超微结构异常,损害线粒体膜电位(MMP),并伴随ROS升高,导致心肌细胞凋亡(图1)。深入研究发现Hey2高表达与能量代谢共激活因子(Ppargc1,Esrra,Nrf1)和脂肪酸氧化肉碱棕榈酰转移酶(Cpt1,Cpt2)低表达显著负相关,表明心肌细胞中HEY2水平升高导致线粒体生物合成和能量代谢下降。
该研究首先观察到HEY2蛋白在扩张型心肌病样本中表达升高,提示HEY2高表达与心力衰竭有关联。进一步研究发现,斑马鱼心肌细胞特异性过表达Hey2导致心室扩张,射血分数降低,心室舒张末期内径增加,最终发展为心力衰竭。此外,细胞外基质胶原蛋白和纤连蛋白表达升高,与马松染色和天狼猩红染色显示胶原纤维沉积增加一致。同时,胚胎心肌蛋白亚型与成年心肌亚型表达比值上升,表明hey2心肌过表达导致斑马鱼心脏发生病理重构和心力衰竭。通过透射电镜检测分析,Hey2心肌过表达引起线粒体数目减少、膜和嵴等超微结构异常,损害线粒体膜电位(MMP),并伴随ROS升高,导致心肌细胞凋亡(图1)。深入研究发现Hey2高表达与能量代谢共激活因子(Ppargc1,Esrra,Nrf1)和脂肪酸氧化肉碱棕榈酰转移酶(Cpt1,Cpt2)低表达显著负相关,表明心肌细胞中HEY2水平升高导致线粒体生物合成和能量代谢下降。
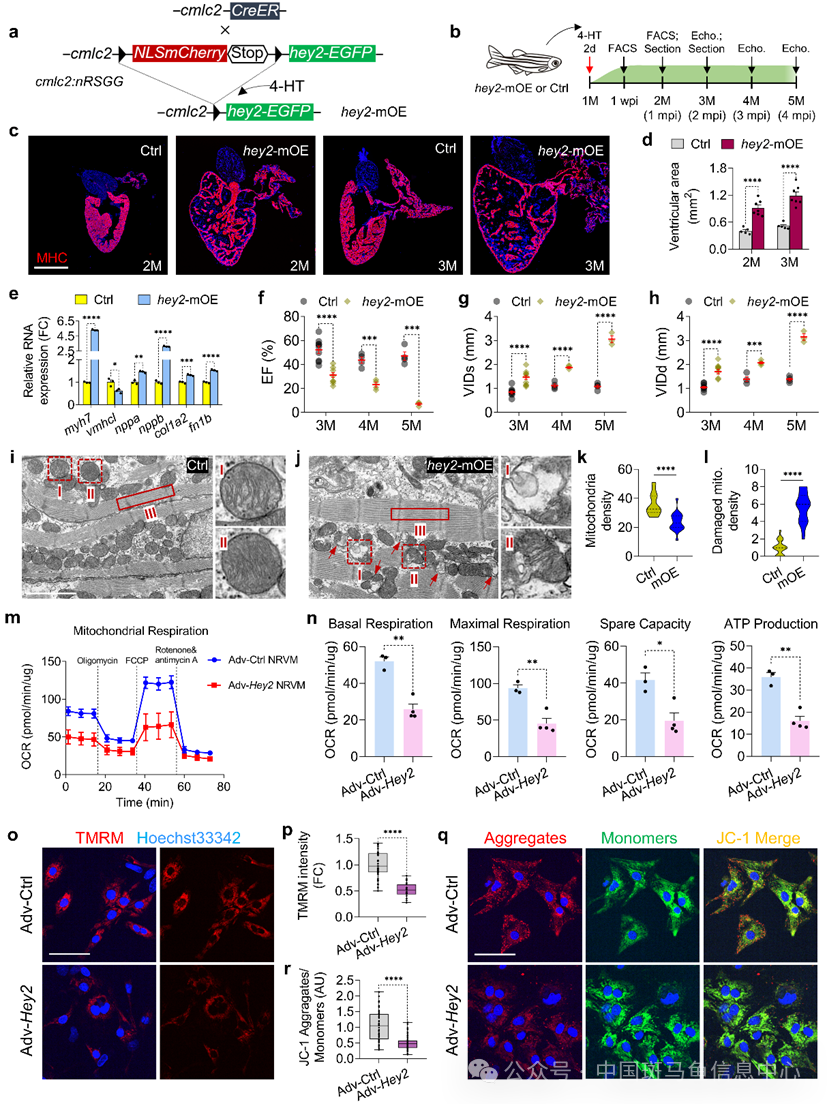
图1 Hey2过表达导致心肌线粒体氧化呼吸异常,心脏发生病理性重构和心力衰竭组蛋白去乙酰化与HEY2介导的转录抑制有关。研究人员通过大鼠心肌细胞组学技术包括染色质占有率和可及性分析,阐明Hey2高表达引起组蛋白去乙酰化酶HDAC1结合增加,组蛋白K9/K27乙酰化减少,并伴随染色质开放程度降低,从而控制能量代谢激活因子表达。相反,在敲低Hey2的大鼠新生心肌细胞中,Ppargc1、Esrra、Nrf1与Cpt1、Cpt2启动子区域上HDAC1结合减少,染色质可及性升高,进而导致其表达增强(图2)。重要的是,增加PPARGC1A/ESRRA能够拯救HEY2过表达引起的人类心肌细胞线粒体缺陷及恢复斑马鱼受损的心脏功能。
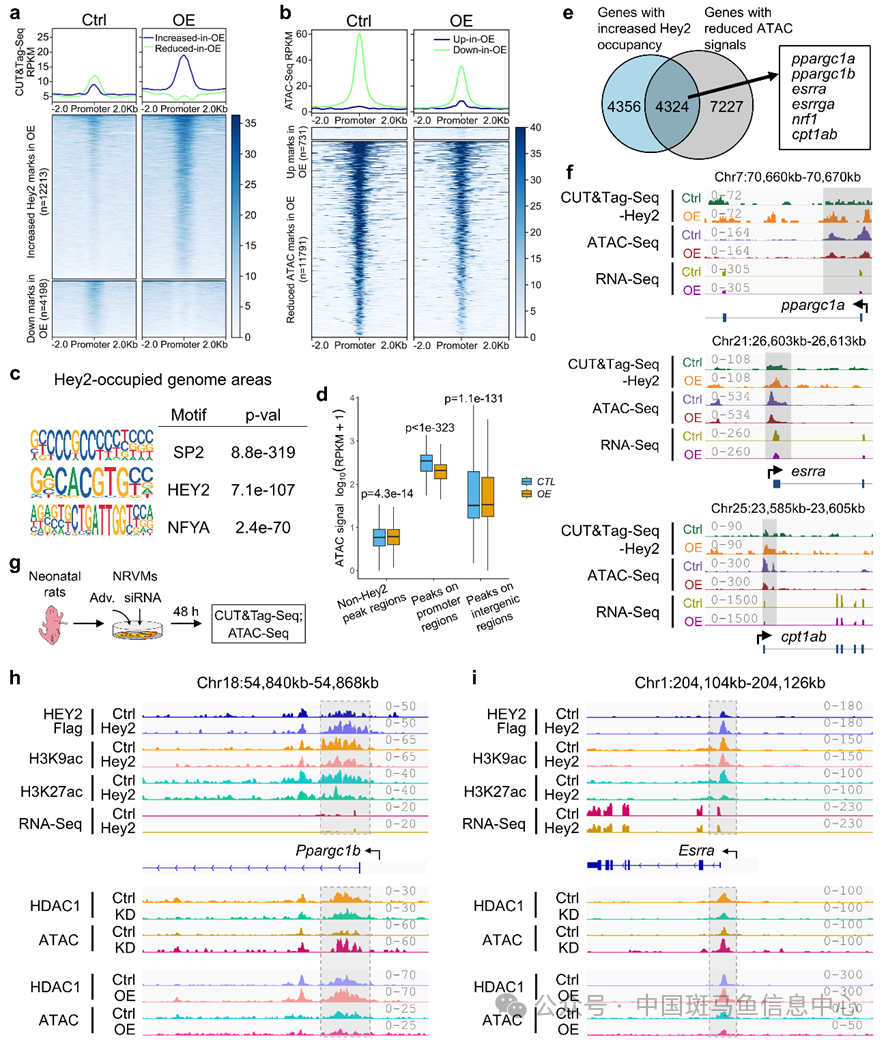
图2 HEY2通过招募HDAC1,调控组蛋白去乙酰化、染色质可及性及基因转录抑制最后,研究人员在成年小鼠心脏中诱导Hey2敲除,观察到线粒体氧化呼吸链和能量代谢基因表达增加,左心室射血分数升高,心脏功能增强,并且能够缓解阿霉素诱导的心肌损伤和衰竭。因此,在正常生理状态下,HEY2通过招募HDAC1,调控组蛋白去乙酰化和染色质可及性,限制能量代谢共激活因子(Ppargc1)和脂肪酸氧化基因(Cpt1a/Cpt2)的过度表达,实现心脏代谢和功能的稳态维持;而在应激状态下,HEY2表达升高,Ppargc1和Cpt1a/Cpt2转录受到抑制,从而降低线粒体氧化呼吸和能量生成,诱发心脏扩张与衰竭(图3)。综上所述,该研究揭示了HEY2/HDAC1-Ppargc1/Cpt轴协调线粒体代谢、心脏功能及稳态维持的新型生物学机制,有望为扩张性心肌病和心力衰竭提供潜在干预策略。
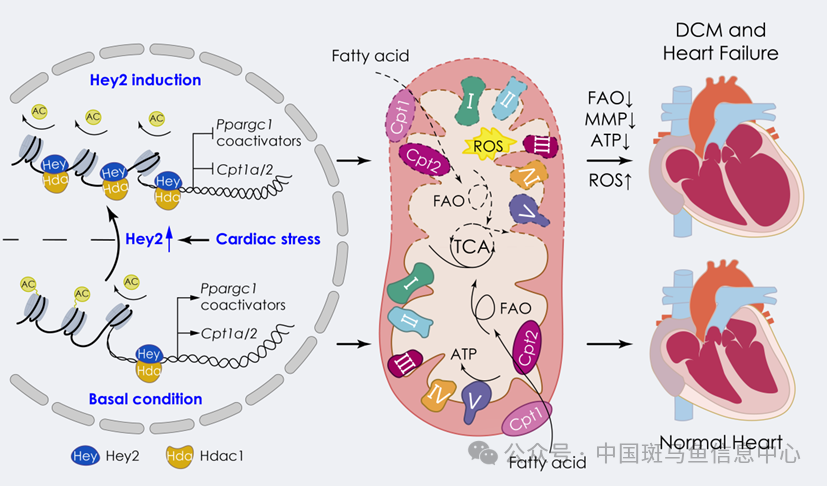
图3 HEY2调控线粒体氧化呼吸与心脏能量代谢模式图华东师范大学钟涛教授、广东省人民医院朱平主任为该论文共同通讯作者。华东师范大学和广东省人民医院研究合作团队佘培露博士后、华东师范大学高邦君博士、李东亮副教授和东南大学博士生吴晨为共同第一作者。该研究得到科技部国家重点研发计划项目、国家自然科学基金项目、广东省基础与应用重大专项等项目资助。






