T淋巴细胞是脊椎动物适应性免疫中细胞免疫的核心,其发育始于淋巴前体细胞向胸腺迁移与定植,该过程被称为“胸腺归巢”。表观遗传修饰在调控T细胞胸腺内分化、重塑与功能多样性中发挥重要作用,但在胚胎发育过程中是否调节T细胞胸腺归巢仍属未知。观察和鉴定淋巴前体细胞向胸腺迁移和归巢具有一定难度和挑战性,因为哺乳动物胚胎在子宫内发育,无法直接观察到淋巴前体细胞迁移至胸腺,而斑马鱼因其体外受精、胚胎透明的特性,为实时观察胚胎内T细胞胸腺归巢提供了理想模型。2023年,钟涛研究团队通过斑马鱼突变体和人类造血干细胞,揭示了ATF7IP/SETDB1介导的组蛋白甲基化修饰是协调造血干祖细胞(HSPC)增殖与多种血液谱系分化的关键检验点(checkpoint)(Wu et al., PNAS 2023)。ATF7IP作为表观调节因子,通过控制SETDB1核定位和泛素化修饰,维持SETDB1 组蛋白三甲基(H3K9me3)转移酶的活性,在HSPC多能性维持和肿瘤发生中发挥关键作用,但是ATF7IP/SETDB1介导的组蛋白甲基化修饰在淋巴前体细胞胸腺归巢过程中是否发挥关键调节功能还是一个未知之谜。

近日,华东师范大学钟涛研究合作团队在Nature Communications杂志在线发表题为"ATF7IP/SETDB1-mediated epigenetic programming regulates thymic homing and T lymphopoiesis of hematopoietic progenitors during embryogenesis"的研究论文,通过斑马鱼胚胎延时成像,结合成年小鼠移植实验,阐明ATF7IP/SETDB1介导的H3K9me3修饰在淋巴前体细胞胸腺归巢与分化中发挥重要的进化保守功能。ATF7IP与SETDB1相互作用,触发免疫调控和免疫疾病易感因子Bach2b基因位点上H3K9三甲基化修饰并抑制其表达,进而上调趋化因子受体Ccr9a基因和淋系调节因子Irf4a的转录表达,最终促进淋巴前体细胞胸腺归巢及T淋巴细胞分化(图1)。
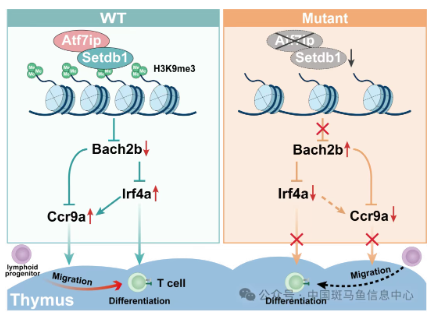
图1 ATF7IP/SETDB1介导的表观遗传修饰调控T淋巴前体细胞向胸腺归巢与分化
该研究首先观察到,斑马鱼atf7ip和setdb1b突变体中早期T细胞标志基因及功能性T细胞因子表达显著降低。通过流式细胞与电镜检测深入分析,证实突变体胸腺中rag2+T细胞数量减少,而胸腺上皮细胞发育不受影响(图2a-d);同时在淋系前体细胞中上调atf7ip或setdb1b挽救T细胞发育缺陷,表明突变体T细胞缺陷是由细胞自主性功能障碍所导致。进一步通过胚胎延时成像观察到,在野生型胚胎中, coro1a+lyz-淋系定向祖细胞(呈圆形)逐渐迁移至胸腺(图2e),而atf7ip和setdb1b突变体胸腺中仅有极少数coro1a+lyz-细胞发生迁移(图2f, g),证明突变体胸腺归巢受阻。
ATF7IP作为SETDB1的表观因子,调节H3K9三甲基转移酶活性。作者通过淋系全基因组H3K9me3 CUT&Tag和RNA-seq分析,确定自身免疫疾病易感转录因子BACH2B为ATF7IP/SETDB1介导的H3K9三甲基化修饰的直接靶标(图2h-l)。由于趋化因子受体 Ccr9a 和淋系调节因子 Irf4a 在突变体中显著下调,作者进一步利用CUT&Tag-qPCR实验证明BACH2b直接结合Ccr9a和Irf4a的启动子,并抑制其荧光素酶活性;当 Ccr9a 和 Irf4a 启动子区域Maf 位点(Bach2b 结合位点) 发生突变时,这种抑制效应被消除。重要的是,敲低Bach2b或过表达Irf4a能完全恢复T淋巴细胞向胸腺迁移与分化,而过表达Ccr9a只能挽救突变体胸腺归巢缺陷。因此,ATF7IP/SETDB1复合物通过H3K9me3修饰沉默Bach2b表达,进而解除其对Ccr9a和Irf4a的转录抑制,维持T细胞正常迁移和发育。同时,Irf4a可以通过增强Ccr9a转录表达调节淋系前体细胞向胸腺迁移(图1)。
为探究ATF7IP在哺乳动物中的功能保守性,研究人员通过两种互补的Cre重组酶等位基因在小鼠中敲除ATF7IP,发现在多数组织中敲除Atf7ip(CAG-CreERT2;Atf7ipf/f)或在血液组织中条件性敲除Atf7ip(Mx1-iCre; Atf7ipf/f )造成早期T祖细胞(ETP)数量和比例均显著下降,提示其胸腺归巢和定植能力存在缺陷。此外,双阴性(DN)T细胞(包括DN1、DN2、DN3和DN4胸腺细胞)、双阳性T细胞及CD4+、CD8+单阳性T细胞的数量和比例也明显减少。细胞移植试验进一步证实,Atf7ip缺失导致造血前体细胞在受体小鼠胸腺中的定植能力减弱,但在脾脏中未见差异,表明ATF7IP调控造血祖细胞迁移并定植于胸腺(图2m-p)。这些研究结果充分证明ATF7IP/SETDB1介导的表观遗传编程在小鼠和斑马鱼中具有协调造血祖细胞向胸腺迁移与分化的进化保守功能。
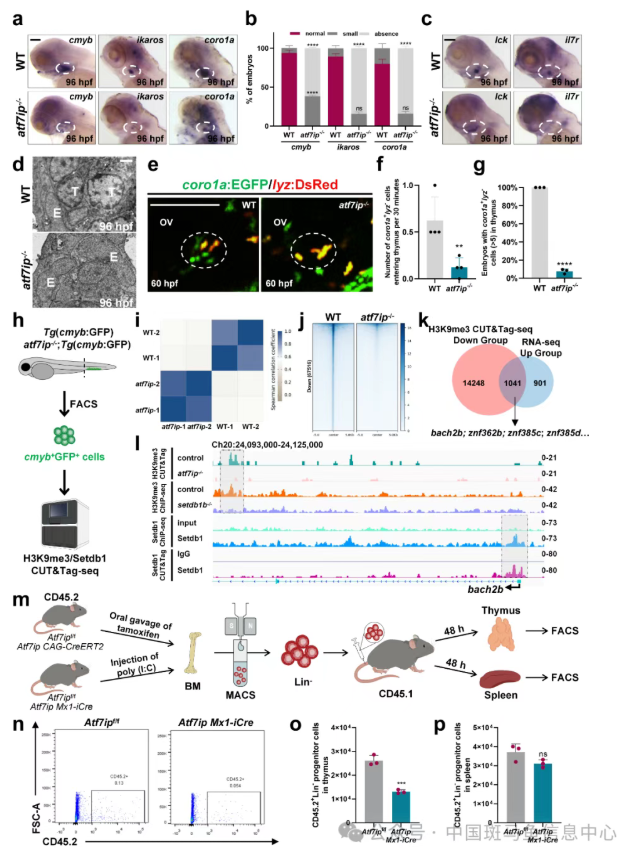
图2 ATF7IP/SETDB1通过H3K9me3修饰调节胚胎时期T淋巴前体细胞迁移与分化
本研究论文确立了ATF7IP/SETDB1介导的表观遗传编程在调控T淋系祖细胞胸腺归巢与分化中的关键作用,为理解人类T淋巴细胞疾病机制提供了重要启示。华东师范大学上海调控生物学重点实验室钟涛教授和广东省人民医院朱平教授为该研究的共同通讯作者。华东师范大学博士研究生陈雯琪、吴佳欣、李娟和广东省人民医院博士后佘培露为该研究的共同第一作者。本研究得到了国家重点研发项目,自然科学基金、上海市和广东省科委等项目的支持。






