理解生命起始阶段基因是如何被精确激活,是发育生物学领域的核心科学问题。其中,受精后发生的母源-合子转换(maternal-to-zygotic transition, MZT)是一个关键时期,在此阶段合子基因开始转录。然而,由于新生RNA的表达水平极低,母源RNA占比大,传统单细胞转录组测序技术难以对新合成的合子RNA和已存在的母源RNA进行高灵敏度检测和区分,因此亟需更加敏感和适用于活体胚胎模型的技术平台。此前,胡鹏教授博士后期间在宾夕法尼亚大学吴昊教授实验室合作开发了单细胞新生转录本检测技术(scNT-seq)(Qiu et al., Nature Methods, 2020),实现在单细胞水平对新合成RNA进行捕获与测定。然而,该技术尚未在鱼类活体胚胎中进行系统优化与应用验证。
2025年7月1日,上海海洋大学水产与生命学院、水产生物育种中心、水产种质资源发掘与利用教育部重点实验室陈良标/胡鹏团队在Nature Communications期刊在线发表题为"Benchmarking metabolic RNA labeling techniques for high-throughput single-cell RNA sequencing"的研究论文,该研究系统比较了多种代谢性RNA标记化学方法与高通量单细胞RNA测序平台的兼容性,并在此基础上筛选出最适合斑马鱼胚胎早期合子基因激活检测的最佳组合。研究显著提升了早期合子转录本的检测灵敏度,成功攻克了鱼类胚胎合子基因表达难以准确解析的技术瓶颈,为深入研究鱼类胚胎发育机制提供了全新的技术手段和实验工具。

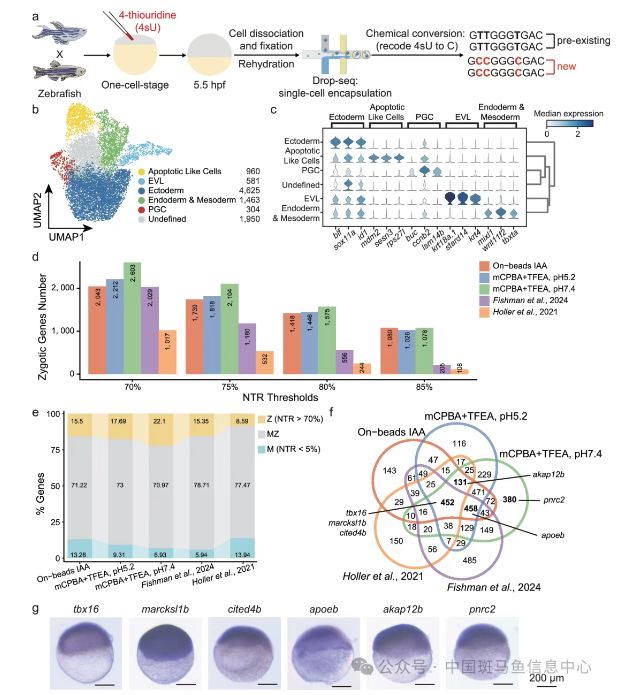
研究团队首先选取了十种目前广泛应用的代谢性RNA化学转化方法,并在Drop-seq单细胞测序平台上对超过52,529个斑马鱼胚胎成纤维细胞(ZF4)进行了系统性评估。结果发现,基于 mCPBA/TFEA 的“on-beads”转化策略表现最为优异,其T-to-C碱基替换率超过8%,在保证RNA完整性和转录本回收率方面也显著优于传统的细胞内标记方法(“in-situ” labeling)。
在此基础上,研究团队将筛选出的最优化学标记方法应用于斑马鱼胚胎早期发育的研究中。通过在单细胞阶段的受精卵中显微注射4-硫尿苷(4sU),实现了对新合成合子转录本的高效标记。基于优化后的方法,取得了以下关键突破:
1)超高灵敏度的新RNA检测:显著增强了新合成RNA的信号强度,有效抑制背景噪音,提升检测准确性;
2)精确的母源与合子基因区分能力:通过计算每个基因中新合成RNA占总RNA的比例,能够更清晰地界定母源转录本与合子激活基因;
3)新合子基因的发现与验证:相比已有研究,本研究识别出更多新激活的合子基因,并通过设计内含子探针进行整胚原位杂交实验验证。
上海海洋大学胡鹏教授为本文通讯作者,实验室博士研究生张晓雯、硕士研究生彭铭健为文章共同第一作者,同时硕士研究生朱江浩也作出重要贡献。研究工作得到了上海海洋大学陈良标教授的大力支持与悉心指导。
此外,前期高通量新生转录本测序技术scNT-seq的开发及本研究的技术路线得到了宾夕法尼亚大学医学院吴昊教授和邱琦博士的重要指导;中国科学院水生生物研究所孙永华研究员和何牡丹副研究员在斑马鱼胚胎实验方面提供了宝贵指导与帮助;澳门大学苗凯教授、南方科技大学陈曦教授与洪旎教授等专家在论文返修过程中给予了专业建议和支持。本研究得到了国家自然科学基金、临港新片区海洋生物医药创新平台科技发展专项资金等项目的资助。
参考文献:
1.Qiu, Q., Hu, P., Qiu, X., Govek, K. W., Cámara, P. G., & Wu, H. (2020). Massively parallel and time-resolved RNA sequencing in single cells with scNT-seq. Nature methods, 17(10), 991-1001.
2.Zhang, X., Peng, M., Zhu, J., Zhai, X., Wei, C., Jiao, H., Wu, Z., Huang, S., Liu, M., Li, W., Yang, W., Miao, K., Xu, Q., Chen, L., & Hu, P. (2025). Benchmarking metabolic RNA labeling techniques for high-throughput single-cell RNA sequencing. Nature Communications, 16(1), 5952.






