人类胎盘作为妊娠过程中的核心内分泌器官,在维持母体内分泌稳态、调节生理适应及保障胎儿发育中发挥不可或缺的作用。子痫前期(PE)是一种复杂的妊娠并发症,严重威胁母婴安全,其根本病理基础与胎盘发育缺陷密切相关。事实上,胎盘发育异常已被广泛认为是PE发生的关键病理机制。王雁玲团队2017年首次揭示子痫前期胎盘的内分泌紊乱状态,之后该病理变化被多项研究进一步验证,相关的机制解析亦不断深入。
2025年11月,王雁玲团队应国际权威期刊 《Endocrine Reviews》 邀请,发表题为“Placental Steroid Hormones in Preeclampsia: Multilayered Regulation of Endocrine Pathogenesis”的综述,系统阐释了子痫前期胎盘类固醇激素失衡的特征及其背后的复杂调控网络,从表观遗传、翻译后修饰到激素反馈等多个层面,完整勾勒出子痫前期内分泌紊乱的“多层次”致病机制,为该疾病的机制理解与靶向治疗开辟了新视角。
1. 子痫前期胎盘内分泌紊乱的核心表现:雄激素升高与雌激素降低
研究发现子痫前期患者循环中雄激素(如睾酮T0)水平异常升高,而雌激素(如雌二醇E₂)显著降低。这一激素失衡不仅能够作为疾病早期预测的生物标志,更体现了胎盘激素合成功能的异常(图1),还是母体多种症状发展的核心驱动因素。过量雄激素可诱发血管收缩、血压上升与子宫血流减少,而雌激素不足则影响滋养层细胞分化与血管生成能力。
2. 全景解析子痫前期胎盘内分泌紊乱的多层次调控机制(图2)
该文全面阐述了子痫前期胎盘中类固醇激素合成紊乱背后的复杂网络,勾画了清晰的多层次调控框架。
1)miRNA介导的反馈循环:高雄为主导
子痫前期胎盘中升高的睾酮可诱导miR-22表达,进而抑制雌激素受体ERα,阻断E₂ 通过正反馈促进芳香化酶合成的回路,最终导致E₂ 合成减少,形成“睾酮 ↑ → miR-22 ↑ → ERα ↓ → 雌二醇 ↓”的恶性循环,加剧激素失衡。
2)代谢与表观调控:糖酵解决定细胞命运与激素合成
胎盘内分泌功能的主要执行者为合体滋养层(STB)。新近研究发现由滋养层干细胞向STB分化过程伴随显著的糖脂代谢重编程。糖酵解所产生的乙酰辅酶A通过组蛋白乙酰化控制滋养层分化命运以及类固醇合成等重要功能。这一代谢重编程受损可直接导致合体化障碍与类固醇激素合成途径紊乱。
3)翻译后调控:蛋白质O-GlcNAc修饰耦合应激信号
STB分化进程中发生活跃的蛋白质O-GlcNAc修饰。子痫前期直接相关的缺氧、炎性等细胞应激信号增强H2S合成酶CSE和转录因子GATA3的O-GlcNAc修饰,提升其酶活性与稳定性,通过影响雄激素受体活化以及关键雄激素合成酶(如3β-HSD1、17β-HSD3)表达,直接导致STB分化异常和雄激素过量生成。
4)褪黑素与性激素的反馈互动:胎盘内分泌稳态的网络调控
胎盘中雌激素通过GPER1–PKA–CREB通路促进褪黑素合成,而褪黑素则反馈调控性激素合成酶表达。子痫前期胎盘中反馈调节被破坏,由于雌激素不足使褪黑素合成减少,而减少的褪黑素可补偿雌雄激素失衡的进一步加剧。故而外源补充褪黑素反而会导致内分泌失衡加剧和胎盘/胎儿发育不良。多项研究表明胎盘内分泌稳态依赖精密的反馈网络,故而靶向内分泌环节干预子痫前期的策略选择需慎重。
该文在综合阐释现有研究证据的基础上,进而指出未来研究的三大方向:探寻雄激素过量产生的始动因素、揭示代谢与内分泌交互机制、开发选择性降低胎盘雄激素且不影响母婴健康的新型疗法。这些探索将为最终改善子痫前期妊娠结局奠定理论基础。
该文通讯作者为王雁玲研究员与邵璇副研究员,杨韵博士与博士研究生张珊珊为共同第一作者,博士研究生房霄与硕士研究生邵腾琪参与论文撰写。
文章链接:https://doi.org/10.1210/endrev/bnaf039
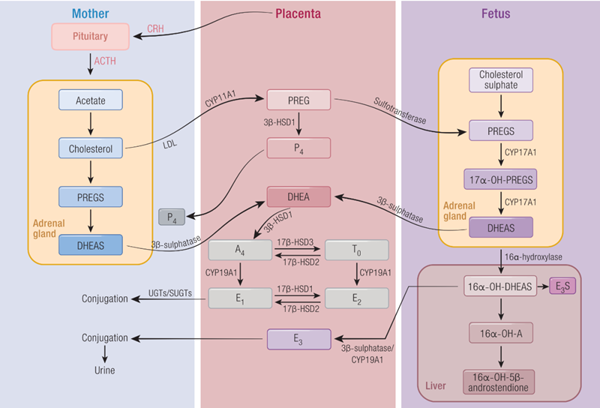
图1 母体-胎盘-胎儿单元中类固醇激素的生物合成途径

图2 子痫前期胎盘内分泌紊乱的多层次调控机制






