传统的脂质纳米颗粒(Lipid Nanoparticle,LNP)在全身给药后,绝大部分会富集在肝脏。这种固有的“肝脏趋向性”严重限制了LNP在肝外疾病治疗中的应用。尽管研究人员已尝试多种策略(例如靶向配体修饰、高通量脂质库筛选等),但仍面临一项重大挑战:如何理性、可预测地设计能够特异性靶向特定器官的递送载体,而非依赖耗时且盲目的经验性筛选。
2025年9月1日,中国科学院动物研究所魏妥研究组联合北京大学未来技术学院程强课题组,在《Nature Materials》杂志上在线发表了题为“Tissue-specific mRNA delivery and prime editing with peptide–ionizable lipid nanoparticles”的研究论文。研究团队将生物学中结构多变的多肽与脂质纳米技术中的可电离脂质这两大类生物材料融合,创造出一种全新的肽基可离子化脂质(Peptide Ionizable Lipid,PIL)材料,开发了名为PILOT(Peptide Ionizable Lipid-driven Organ Targeting)的器官靶向mRNA递送平台(图1)。PILOT平台可在无需配体修饰和额外脂质加入的情况下,实现多器官的特异性mRNA递送,且所发现的PIL靶向修饰策略具有通用性和可预测性。具体来说,1)赖氨酸/精氨酸修饰实现mRNA的肺靶向递送;2)半胱氨酸/组氨酸/酪氨酸/苯丙氨酸修饰实现mRNA的肝靶向递送;3)谷氨酸/天冬氨酸/脯氨酸/色氨酸修饰及Nα-乙酰化赖氨酸/精氨酸修饰实现mRNA的脾脏特异性递送;4)赖氨酸-酪氨酸二肽的加入显著提升mRNA的胸腺靶向递送;5)阿仑膦酸的加入显著提升mRNA的骨骼靶向递送。
进一步地,研究团队基于肝靶向及肺靶向PILOT LNP,挑战了在递送上难度极大的先导编辑技术,通过“all-in-one”的方式共同递送PEmax mRNA和工程化向导RNA(epegRNA),实现了在肝脏中13.3%的先导编辑编辑效率以及在肺部7.4%的先导编辑效率(图2)。这同时也是首次通过全身系统性给药在肺部实现高效先导编辑的报道,为治疗肺遗传病奠定了坚实的技术基础。
总之,PILOT靶向递送平台提供了一套可预测、模块化的“设计规则”,极大地减少了开发器官靶向疗法的盲目性和时间成本。这项技术预示着未来开发针对肺部疾病、脾脏疾病、免疫系统疾病和骨相关疾病的精准基因药物将成为可能,将mRNA技术从疫苗领域推向治疗更多重大难治性疾病的全新舞台。
中国科学院动物研究所魏妥研究员与北京大学未来技术学院程强研究员为该研究的共同通讯作者,北京大学未来技术学院博士后林艺和中国科学院动物研究所硕士毕业生李梦尧为共同第一作者。该研究得到了国家重点研发计划、科技创新2030重大项目、国家自然科学基金、北京市自然科学基金等项目资助。
文章链接:https://www.nature.com/articles/s41563-025-02320-9
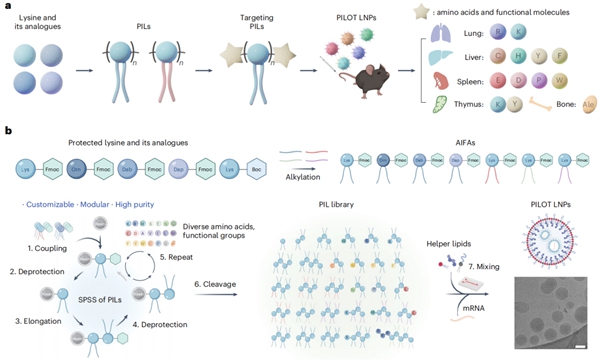
图1. PILOT技术介导多器官特异性的mRNA递送。
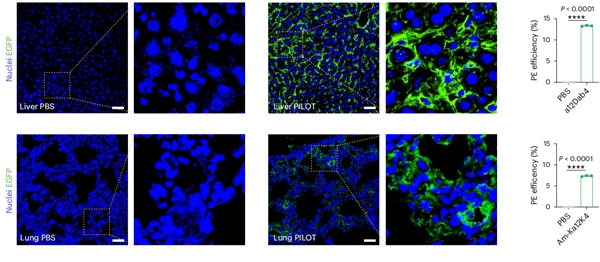
图2. Liver和Lung PILOT LNP介导肝和肺特异性先导编辑。






