想象一下:你注射了一支常用抗生素后,皮肤突然红肿刺痛;或者被蚊虫叮咬后,瘙痒难耐并鼓起大包;又或者皮肤长期出现引发瘙痒的红斑…...这些看似不相干的生理反应,可能与免疫系统中的一个关键角色——肥大细胞及其表面受体Mas相关G蛋白偶联受体X2(MRGPRX2)密切相关,它们共同推动了免疫机制的新认识。
MRGPRX2——作为肥大细胞非经典的激活受体
肥大细胞是免疫系统的前线哨兵,广泛分布在皮肤和呼吸道等屏障组织。传统上,它们通过IgE 介导的FcεRI通路识别过敏原,释放组胺和蛋白酶等介质引发过敏反应。然而,许多临床上肥大细胞介导的反应并不依赖于IgE,这暗示了“非经典”激活机制的存在。
MRGPRX2是近年来受到广泛关注的新型受体,主要表达于人类肥大细胞表面。它能识别多种阳离子配体,包括常见药物(如吗啡、万古霉素)、宿主抗菌肽(如LL-37)、神经肽(如Substance P)和蛋白酶裂解产物等。这些配体激活MRGPRX2,介导肥大细胞脱颗粒,促进炎症因子(如IL-6、IL-8)的释放,引发快速的免疫反应。这一过程不依赖IgE,被称为“伪过敏反应”,是许多药物的不良反应之一,通常表现为患者的不适和炎症反应。
此外,MRGPRX2(或小鼠同源受体MrgprB2)能够被革兰氏阳性菌分泌的群体感应分子激活,进而诱导肥大细胞脱颗粒,抑制细菌生长并防止生物膜形成,在早期抗感染中发挥积极作用。然而,当MRGPRX2持续暴露于低剂量内源性配体(如神经肽或抗菌肽)可能导致肥大细胞长期激活,进而引发慢性炎症,例如,慢性荨麻疹、特应性皮炎、银屑病等疾病。
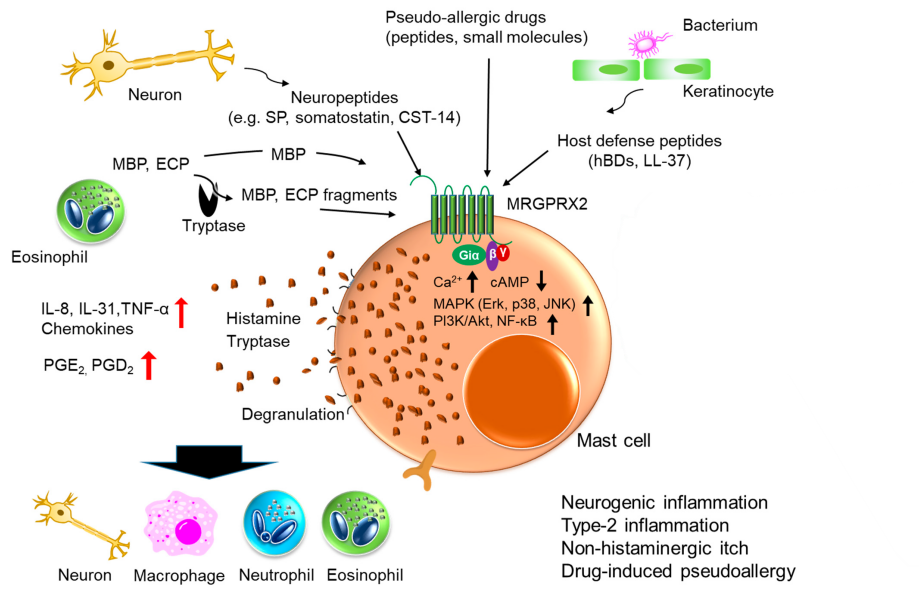
图1:图中展示了肥大细胞上的 MRGPRX2 可被各种内源性和外源性带正电荷的激活剂(例如,神经肽物质 P、药物、化学刺激物、细菌群体感应分子等)激活;而后介导肥大细胞脱颗粒导致蛋白酶、细胞因子、趋化因子的释放和其他免疫细胞的募集。这一过程被认为在神经源性炎症、2 型炎症、非组胺能瘙痒和药物诱导的假性过敏中起重要作用[1]。
靶向MRGPRX2的潜在治疗策略
MRGPRX2通过整合来自神经末梢的神经肽、上皮细胞源的抗菌肽和外源药物的信号,在神经-免疫-上皮系统之间建立了功能性连接,作为这一通路的关键枢纽。它不仅揭示了非IgE依赖性免疫机制的复杂性,也为治疗伪过敏反应及慢性炎症性皮肤病提供了新的靶点。
目前已有多家公司研发了MRGPRX2拮抗剂。其中Escient公司推出的小分子药物EP262,作为MRGPRX2拮抗剂,针对慢性荨麻疹和特应性皮炎等肥大细胞介导的疾病,正处于临床二期研究中。
药物开发的挑战:
1.物种特异性:尽管Mrgprb2是人类MRGPRX2在小鼠中的同源物,但二者序列同源性仅为53%,导致与激动剂和拮抗剂的相互作用差异。常用的临床前安全性测试动物(如狗、小型猪和非人灵长类动物)与人类MRGPRX2的序列差异较大。例如,犬和猪具有较长的N末端结构域,可能影响配体结合。这为该受体在动物实验中的研究带来困难,也为临床前药物开发带来挑战。
2.单核苷酸多态性: MRGPRX2包含107个错义SNP,其中多个突变位于配体结合位点,如图2所示,这些变异可能改变配体与受体的结合方式,从而影响药物的效能。

图2:MRGPRX2 单核苷酸多态性 (SNP)。MRGPRX2 二级结构的蛇形图,每个圆圈代表氨基酸残基,带有一个字母代码。红色标注表示有害突变,绿色标注表示耐受突变。图中标注了配体结合及G蛋白结合位点的大致范围[2]。
因此,MRGPRX2的药物开发面临诸多挑战,首先需要建立安全且可靠的人源化动物模型来评估药物的效果与安全性;此外,在药物设计过程中,还需充分考虑SNP对药物开发可能带来的潜在影响,以确保开发的药物具备更高的可靠性和有效性。
结语:开启慢性炎症治疗的新篇章
MRGPRX2的发现,重塑了我们对肥大细胞激活机制的认识。它揭示了肥大细胞作为免疫系统与神经系统、外界环境与内在稳态之间关键整合者的复杂角色。深入了解MRGPRX2的精确调控机制、以及如何安全有效地靶向它,治疗那些由MRGPRX2介导的药物不良反应、慢性荨麻疹、特应性皮炎瘙痒等,同时避免影响经典的IgE通路,是未来研究的核心方向。
References:
[1].Ogasawara, H. and M. Noguchi, Therapeutic Potential of MRGPRX2 Inhibitors on Mast Cells. Cells, 2021. 10(11).
[2].Roy, S., et al., Multifaceted MRGPRX2: New insight into the role of mast cells in health and disease. J Allergy Clin Immunol, 2021. 148(2): p. 293-308.






