近日,中国科学院广州生物医药与健康研究院许永团队针对溴结构域家族蛋白抑制剂选择性难题,报道了一种在急性髓系白血病(AML)治疗中具有显著疗效的BRD9选择性抑制剂Y22073(专利申请号:2025100176011.1),为AML 精准治疗提供了全新解决方案。相关成果以“Key imidazolyl groups that induce phenylalanine flipping enhance the efficacy of oral BRD9 inhibitors for AML treatment”为题发表于药物化学领域Top期刊Acta Pharmaceutica Sinica B上。
许永团队长期致力于创新药物靶点发现、作用机制解析及创新药物研究,特别是在肿瘤表观遗传治疗领域获得了系统性的研究成果(J Med Chem, 2022, 65, 5760; Bioorg Chem, 2024, 142, 106950; J Med Chem, 2024, 67, 6952; J Med Chem, 2024, 67, 21577)。溴结构域蛋白9(BRD9)是哺乳动物SWI/SNF染色质重塑复合物家族中ncBAF的核心组分,该组分是目前癌症中频发突变的表观遗传调控复合物。BRD9通过特异性识别组蛋白上的乙酰化赖氨酸,招募转录复合物并介导下游转录调控与靶基因的表达。BRD9在AML等多种癌症中发挥关键表观遗传调控功能,已成为抗肿瘤药物研发的新兴靶点。然而现有BRD9抑制剂在AML治疗中始终未展现显著的体内外疗效,这严重制约其临床转化潜力。
针对溴结构域家族蛋白结构高度相似导致的抑制剂选择性难题,团队通过优势骨架化合物库筛选、晶体结构解析以及基于结构的药物设计,成功开发出可用于AML治疗的新型BRD9选择性溴结构域抑制剂Y22073。研究人员从基于结构活性关系(SAR)的优化策略中发现了咪唑类化合物具有卓越的体外抗增殖活性。合作团队通过X射线晶体结构解析(分辨率最高达1.78 Å)精准捕捉到BRD9的ZA通道存在一个独特的“可调控开关”——Phe163翻转开关。抑制剂中关键的咪唑药效基团能够诱导BRD9蛋白的Phe163残基翻转并与其形成稳定的π-π相互作用。然而,其他溴结构域(如BRD7、BRD4、CECR2)中对应位置的残基无法与咪唑基形成有效相互作用,直接证明了该机制的特异性。这一分子层面的突破性发现不仅显著提升了化合物的体外活性,也使得Y22073成为首个在AML模型中展现明确疾病表型干预能力的BRD9抑制剂。研究团队还创新性地采用该修饰策略对现有BRD9抑制剂进行结构改造,结果表明,经此策略修饰后的化合物在体外的活性显著提升,进一步证实咪唑基团可通过调控独特的Phe163开关,在提高活性方面发挥关键作用。Y22073表现出良好的溴结构域选择性、代谢稳定性、溶解性并兼具理想的药代动力学特性,在MV4-11异种移植小鼠模型中表现出显著的口服抗肿瘤效果,且无明显毒性。综合其优异的体外活性、体内疗效及成药性特征,Y22073作为具有First-in-Class潜力的BRD9溴结构域选择性抑制剂,为急性髓系白血病的靶向治疗提供了极具临床转化价值的新型候选药物。
许永课题组博士生陈智铭、助理研究员张成和沈慧为本论文的共同第一作者,许永研究员、吴锡山副研究员和张岩副研究员为通讯作者。该项目得到了国家重点研发计划、国家自然科学基金面上项目、广东省“一带一路”联合实验室基金、中国科学院自主部署项目、中国科学院青促会项目和广东省科技厅项目的支持。
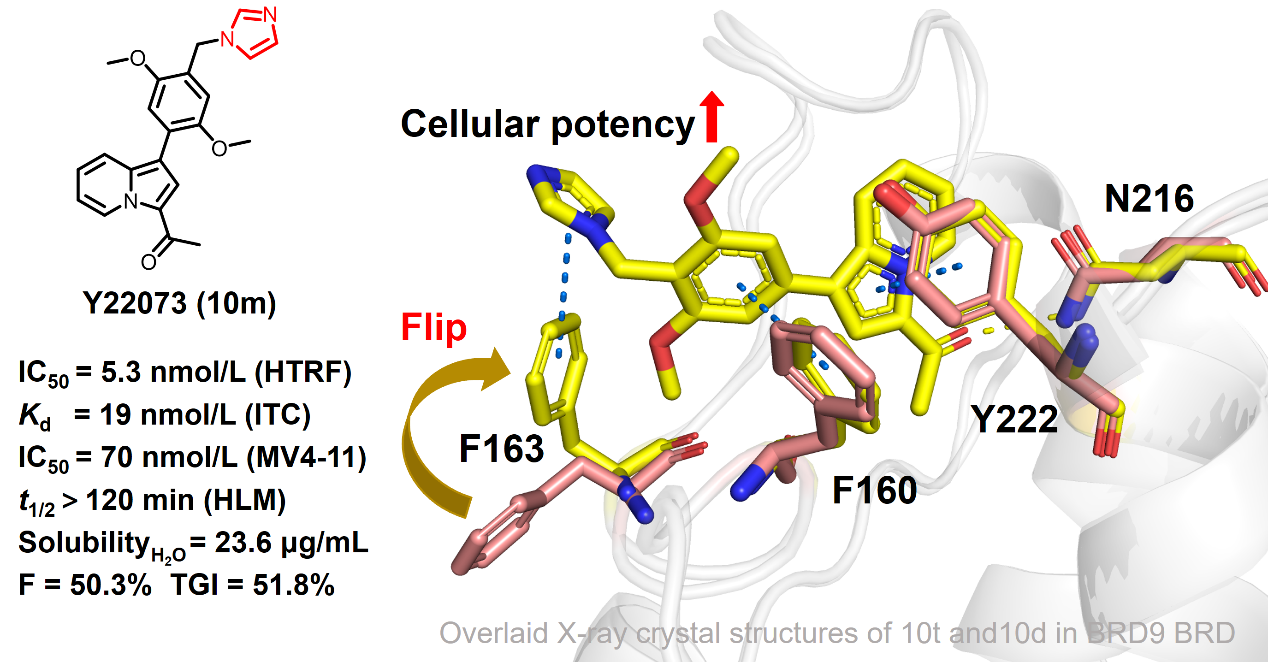
BRD9抑制剂Y22073可作为候选化合物用于AML治疗






