我们的人体存在于纷繁复杂的环境中,时刻需要面对病原体的入侵。我们的机体是怎样区分入侵者和自身呢?这得益于我们免疫系统精密的识别机制,其中“天然免疫系统”充当了安检人员和报警器的工作。2011年,诺贝尔生理学或医学奖授予布鲁斯·博伊特勒(Bruce Beutler)、朱尔斯·霍夫曼(Jules Hoffmann)和拉尔夫·斯坦曼(Ralph Steinman),以表彰他们在天然免疫激活机制方面的开创性发现。布鲁斯·博伊特勒和朱尔斯·霍夫曼的研究揭示:从果蝇到人类,这种防御机制已进化了数亿年。
天然免疫系统作为“生物安检系统”,能像海关安检仪一样精准分辨外来入侵者与自身细胞。如果细胞携带有“危险品”,会立马拉响警报,并集结免疫大军,歼灭入侵病原体。
每个细胞都携带独特的分子身份证——DNA和RNA。这些核酸分子不仅存储着遗传密码、指导蛋白质合成,更是细胞的身份识别标志。当病毒或细菌入侵时,它们的外源核酸就像伪造的证件,与宿主细胞的遗传信息存在明显差异。而当细胞受损导致自身DNA泄露到不该出现的区域(如细胞质中),这些游离的核酸片段会被免疫系统视为危险信号。此时,细胞内置的分子警报系统就会立即激活,触发免疫防御机制。这种精妙的识别系统,正是人体区分自我与非我的分子基础。
图1 病原体核酸识别:天然免疫的 “第一道警报”
核酸天然免疫的核心是一系列专门识别核酸的模式识别受体(PRRs),他们就像X光扫描仪器,时刻监控着异常的发生。这些受体分布在细胞的不同部位,监测不同类型的核酸,构成了一个立体的监测网络:
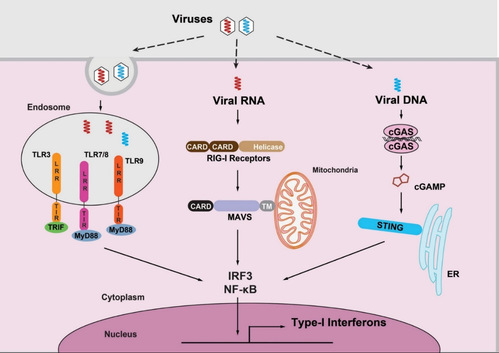
图2 核酸天然免疫示意图
第一类是 “膜上哨兵”—— TLR 家族。部分 TLR 受体分布于细胞膜或内体膜,如同细胞膜上“哨兵”,专门识别进入细胞的外来核酸。TLR3 能抓住病毒复制的双链 RNA,TLR7/8识别单链RNA(如新冠病毒的遗传物质),而TLR9 则能识别富含CpG基序的细菌DNA(如结核杆菌的核酸)。TLR结合目标核酸后,随即启动细胞因子——I型干扰素和炎症因子的释放Kawai T, Ikegawa M, Ori D, Akira S. Decoding Toll-like receptors: Recent insights and perspectives in innate immunity. Immunity. 2024 Apr 9;57(4):649-673. doi: 10.1016/j.immuni.2024.03.004。干扰素与炎性因子如同抵御外敌点燃的狼烟,可以迅速招募免疫细胞到感染部位,同时让感染的细胞处于抗病毒状态,彻底阻断病毒的复制链条。
第二类是 “细胞质 RNA 哨兵” ——RLR 家族。如果病毒绕过细胞膜,直接在细胞质里复制 RNA(如新冠病毒、乙肝病毒),RLR 家族的主要成员RIG-I和MDA5 就会像 “巡逻警” 一样绑定病毒 RNA:RIG-I识别带有5'-三磷酸末端的短双链RNA,MDA5则识别长双链RNA。它们随后激活线粒体抗病毒信号蛋白(MAVS),最终让细胞 “吹响警报”,产生干扰素和炎症因子,召集免疫细胞清除受感染细胞Jiang X, Kinch LN, Brautigam CA, Chen X, Du F, Grishin NV, Chen ZJ. Ubiquitin-induced oligomerization of the RNA sensors RIG-I and MDA5 activates antiviral innate immune response. Immunity. 2012 Jun 29;36(6):959-73. doi: 10.1016/j.immuni.2012.03.022。
第三类是 “细胞质 DNA 哨兵” ——cGAS-STING 通路。这是近年来备受关注的 “防御王牌”。 2008年,美国迈阿密大学医学院癌症研究中心的Glen N. Barber团队与中国武汉大学舒红兵团队先后筛选发现STING蛋白(又称MITA)Ishikawa H, Barber GN. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling. Nature. 2008 Oct 2;455(7213):674-8. doi: 10.1038/nature07317Zhong B, Yang Y, Li S, Wang YY, Li Y, Diao F, Lei C, He X, Zhang L, Tien P, Shu HB. The adaptor protein MITA links virus-sensing receptors to IRF3 transcription factor activation. Immunity. 2008 Oct 17;29(4):538-50. doi: 10.1016/j.immuni.2008.09.003.,证明其能够响应胞质DNA及DNA病毒感染,诱导I型干扰素产生。STING被发现后,一个关键问题悬而未决:细胞是如何感知胞质DNA并激活STING的?这个问题的答案由美国德克萨斯大学西南医学中心陈志坚团队在2013年最终揭示。他们鉴定出cGAS(cyclic GMP-AMP synthase)是催化生成第二信使cGAMP的关键酶,从而完整揭示了cGAS-STING信号通路Sun L, Wu J, Du F, Chen X, Chen ZJ. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway. Science. 2013 Feb 15;339(6121):786-91. doi: 10.1126/science.1232458. 。这一突破性发现填补了 DNA 免疫识别的空白,为陈志坚赢得了 2024 年拉斯克基础医学奖,凸显了该研究的重大科学价值。
当细菌DNA、病毒 DNA(如疱疹病毒),甚至肿瘤细胞泄露的自身 DNA 进入细胞质时,cGAS蛋白会立刻结合这些 DNA,催化生成第二信使cGAMP。cGAMP随后激活内质网上的STING蛋白,启动干扰素警报系统。
从基础研究到临床应用的转化
对核酸天然免疫通路的深入理解正在催生新一代治疗方法。从实验室研究到临床转化,TLR、RLR 和 cGAS-STING 这三位 “基因卫士”已在应用战场上展现出巨大潜力。
在 cGAS-STING 疗法方面,其在肿瘤治疗中展现出令人期待的前景。通过激活cGAS-STING 通路,能增强 T 细胞对肿瘤的攻击能力。2025年4月,中国科学技术大学高大兴教授团队和王育才教授团队协作开发了一种基于cGAS mRNA-LNP的mRNA疫苗佐剂。研究表明,该佐剂能有效促进抗原递呈细胞的激活、T细胞的活化、以及B细胞的成熟和抗原特异性抗体的产生,在激发体液免疫和细胞免疫方面发挥了重要作用Qu Y, Li Z, Yin J, Huang H, Ma J, Jiang Z, Zhou Q, Tang Y, Li Y, Huang M, Zeng Z, Guo A, Fang F, Shen Y, Zhao R, Wang Y, Gao D. cGAS mRNA-Based Immune Agonist Promotes Vaccine Responses and Antitumor Immunity. Cancer Immunol Res. 2025 May 2;13(5):680-695. doi: 10.1158/2326-6066.CIR-24-0804.。
除肿瘤治疗外,cGAMP 等 STING 激动剂还可作为疫苗佐剂,其独特优势在于能高效激活 STING 通路,模拟病毒感染的天然免疫状态,从而显著增强疫苗激活 T 细胞的能力,诱导出更强效、更持久的特异性免疫应答,为新一代疫苗的设计提供了强有力的工具。
尽管 STING 激动剂展现出巨大潜力,但目前全球尚未有STING药物获批上市,多个候选药物正处于临床研发阶段。例如,Exelixis 公司与 Ryvu 公司合作开发的 STING 小分子激动剂已进入早期研究阶段,有望为癌症治疗提供新选择。
TLR 的应用也很广泛:TLR9 激动剂能辅助抗癌,增强免疫细胞对肿瘤的识别;TLR3 激动剂则用于抗病毒,帮助清除慢性乙肝病毒。
挑战与未来展望
尽管核酸天然免疫研究取得了显著进展,但仍面临重要挑战。部分肿瘤会通过 "关闭"cGAS 和 TLR 等通路逃避免疫监视;个体对核酸疫苗的反应存在显著差异,研究发现这与个体基线免疫状态,特别是浆细胞样树突状细胞的I型干扰素 -T/B淋巴细胞网络活化程度密切相关;此外,免疫相关不良反应的管理以及联合治疗策略的优化等都是需要解决的问题。
未来的研究将聚焦于开发更精准的调控手段,实现对核酸免疫通路的时空特异性调节。随着单细胞技术、人工智能和基因编辑等新技术的发展,我们有望更深入地理解核酸天然免疫的精细调控机制,开发出更加安全有效的治疗策略。
核酸天然免疫系统的发现和阐释,不仅揭示了生命体防御机制的精妙设计,也为未来医学发展提供了新的方向和希望。从陈志坚团队对 cGAS-STING 通路的突破性发现,到 TLR 激动剂的临床应用,每一次科学突破都让我们更加惊叹于自然选择的智慧。通过深入理解这些基本机制,我们终将能够更好地战胜疾病,守护人类健康。
作者:宋柳萍、高大兴
参考文献:
Kawai T, Ikegawa M, Ori D, Akira S. Decoding Toll-like receptors: Recent insights and perspectives in innate immunity. Immunity. 2024 Apr 9;57(4):649-673. doi: 10.1016/j.immuni.2024.03.004.
Jiang X, Kinch LN, Brautigam CA, Chen X, Du F, Grishin NV, Chen ZJ. Ubiquitin-induced oligomerization of the RNA sensors RIG-I and MDA5 activates antiviral innate immune response. Immunity. 2012 Jun 29;36(6):959-73. doi: 10.1016/j.immuni.2012.03.022.
Ishikawa H, Barber GN. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling. Nature. 2008 Oct 2;455(7213):674-8. doi: 10.1038/nature07317.
Zhong B, Yang Y, Li S, Wang YY, Li Y, Diao F, Lei C, He X, Zhang L, Tien P, Shu HB. The adaptor protein MITA links virus-sensing receptors to IRF3 transcription factor activation. Immunity. 2008 Oct 17;29(4):538-50. doi: 10.1016/j.immuni.2008.09.003.
Sun L, Wu J, Du F, Chen X, Chen ZJ. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type I interferon pathway. Science. 2013 Feb 15;339(6121):786-91. doi: 10.1126/science.1232458.
Qu Y, Li Z, Yin J, Huang H, Ma J, Jiang Z, Zhou Q, Tang Y, Li Y, Huang M, Zeng Z, Guo A, Fang F, Shen Y, Zhao R, Wang Y, Gao D. cGAS mRNA-Based Immune Agonist Promotes Vaccine Responses and Antitumor Immunity. Cancer Immunol Res. 2025 May 2;13(5):680-695. doi: 10.1158/2326-6066.CIR-24-0804.






