当新手父母满心期待迎接新生命时,一个隐藏的威胁可能正在悄然逼近——母体免疫系统的异常激活。近年来科学研究揭示,孕期感染、压力等多种应激因素引发的免疫紊乱,可能悄然改变胎儿的神经发育轨迹,增加自闭症谱系障碍(ASD)的发生风险。这场发生在子宫内的 “免疫风暴”,正在成为解开自闭症病因之谜的关键线索。

图 1. 来自星星的孩子。
自闭症儿童普遍存在社交沟通障碍,他们可能难以理解他人的情感、表情或语言,也难以用常规方式表达自己的需求和感受。他们近在眼前,但他们的内心世界却似乎与我们隔着一片浩瀚的星空,难以触及和理解。
孕期警报:免疫系统的双刃剑
人体的免疫系统如同精密的防御网络,在孕期更肩负着双重使命:既要保护母体免受病原体侵袭,又要容忍胎儿这个“半外来者”的存在。然而,当病毒感染、细菌入侵或长期压力等应激因素出现时,这个平衡就可能被打破,引发母体免疫激活(MIA)。
流行病学数据为我们敲响警钟:1964 年风疹大流行后,暴露于病毒的人群中自闭症发病率飙升至13%,是正常群体的十余倍。后续研究发现,流感、麻疹等感染都有类似影响。更令人关注的是,冬季受孕的儿童自闭症风险显著升高,这与呼吸道病毒感染高发期高度重合。值得注意的是,风险并非局限于感染本身——孕期肥胖、空气污染、心理压力等非感染因素,同样可能通过激活免疫系统,为胎儿神经发育埋下隐患。
这些看似不同的应激因素,最终都会指向同一个核心:母体血液中炎症因子的飙升。就像一场失控的 “免疫风暴”,过量的IL-6、IL-17A 等细胞因子突破胎盘屏障,直接冲击正在发育的胎儿大脑。研究显示,孕妇高烧达到38.5℃以上并持续超过24小时,会显著增加后代神经发育障碍风险,这正是炎症反应强度与危害程度直接关联的有力证据。
免疫信使:穿越胎盘的 “危险信号”
在这场母体与胎儿的免疫对话中,几种关键细胞因子扮演着 “危险信号” 的角色。IL-6 作为多效性炎症介质,能直接穿越胎盘进入胎儿脑部,干扰谷氨酸能神经元突触形成,导致小脑浦肯野细胞(purkinje cell)功能异常——这些变化在自闭症患者的脑组织研究中已得到证实。实验显示,给怀孕小鼠注射IL-6,后代会出现明显的社交障碍和刻板行为,而使用IL-6 中和抗体则能有效预防这些异常。
IL-17A 则像一把 “神经剪刀”,通过结合胎儿神经元表面的受体,破坏大脑皮质的正常发育秩序。在小鼠模型中,母体IL-17A水平升高会导致胎儿皮层结构紊乱,小胶质细胞过度激活。值得注意的是,直接向胎儿大脑注射IL-17A,能精准复制出自闭症样行为,而阻断IL-17A信号则可避免这些问题。这解释了为何孕期感染引发的Th17细胞过度激活,会成为自闭症的重要风险因素。
除了这些 “主犯”,IL-1β、TNF-α和I型干扰素等“帮凶”也在协同作案。它们通过扰乱神经发生、破坏兴奋/抑制性神经平衡、改变小胶质细胞功能等多种途径,共同塑造着不利于神经发育的微环境。这些细胞因子的联合作用,就像一张无形的网,将胎儿的神经系统拖入异常发育的歧途。
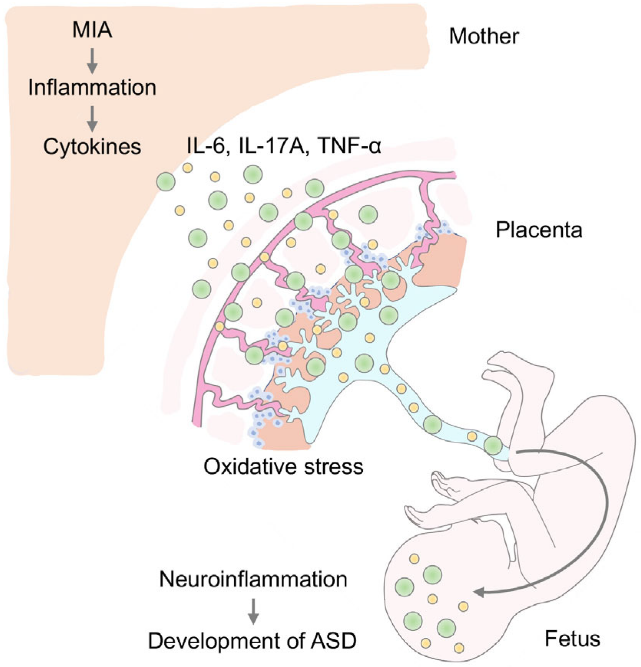
图 2. 母体炎症穿越胎盘诱导后代自闭症(ASD)的发生。
当妈妈在怀孕期间身体出现“免疫激活”(比如感染了病毒、细菌,或者有自身免疫问题、压力过大),身体会启动免疫反应并产生一些叫“细胞因子”的炎症物质,比如IL6、IL-17A、TNF-α等。这些炎症物质会伤害胎盘的结构,还能通过胎盘进入胎儿体内,直接伤害胎儿的大脑和身体,导致胎儿大脑出现神经炎症。这些一系列的变化,最终会增加胎儿出生后患上自闭症的风险。(图片选自Usui et al. International Journal of Molecular Sciences 2023)
子宫内的“免疫哨兵”:NK细胞的双重角色
在母体与胎儿的交界处——母胎界面,一种特殊的免疫细胞正在上演 “善恶交织” 的戏码。子宫自然杀伤细胞(uNK)占孕期母胎界面免疫细胞的70%,它们本是保障妊娠的“功臣”:促进螺旋动脉重塑以保证胎盘供血,分泌生长因子支持胎儿发育,维持免疫耐受防止胎儿被排斥。但在母体免疫激活状态下,这些“哨兵”会变身“破坏者”。研究发现,孕期暴露于病毒模拟物后,uNK细胞会异常激活,释放大量颗粒酶B(GZMB)。这种酶如同“分子剪刀”,能破坏胎儿大脑的皮质结构,导致神经元排列紊乱。实验证据表明,GZMB会激活胎儿脑中的小胶质细胞——这些大脑的“清道夫”在过度激活后,可能会错误修剪突触连接,干扰神经环路形成(Bian et al. Immunity 2025)。
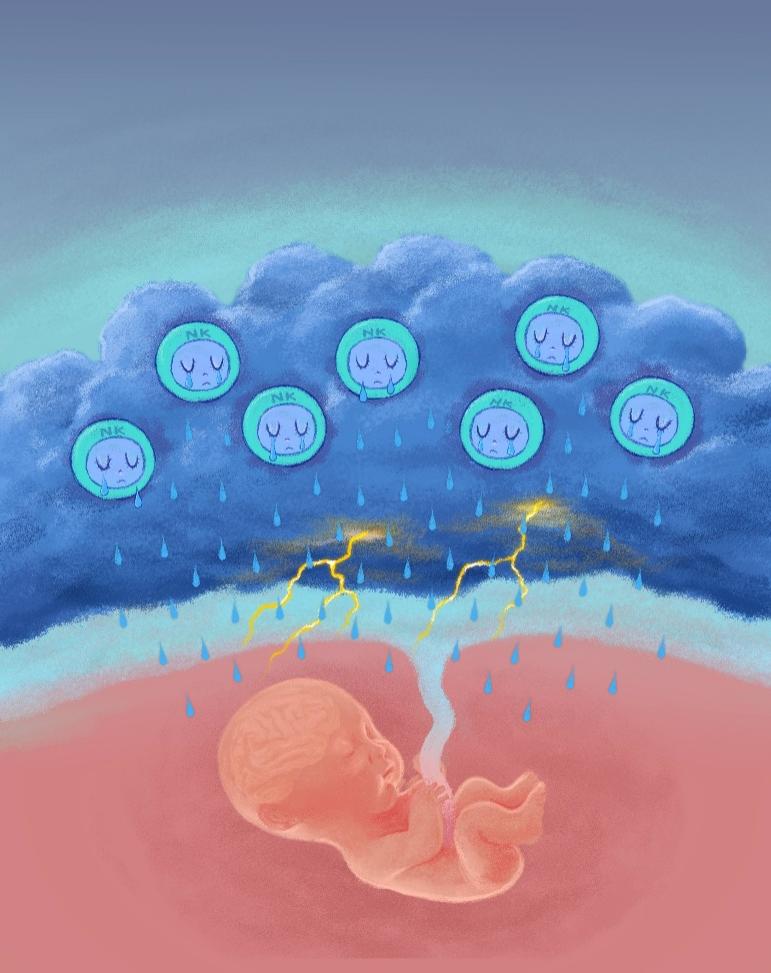
图 3. 异常激活的uNK细胞释放颗粒酶B影响后代神经发育。
孕期病毒感染扰乱了母胎界面的免疫微环境(乌云密布,电闪雷鸣),受到该扰动影响的母体NK细胞释放出胞外颗粒酶B(泪滴),导致胚胎脑神经发育紊乱和神经免疫异常。
临床研究也发现,自闭症儿童母亲的NK细胞存在明显功能异常——基础状态下过度活跃,然而在需要它们时却反应迟钝,这种“疲惫”表型可能正是长期免疫激活的结果。
预防的曙光:阻断风险的关键窗口
尽管孕期免疫激活的危害令人担忧,但科学研究已为我们指明了预防方向。关键在于筛选标志物用于识别高风险孕妇,并在神经发育的关键窗口期(人类孕期前20周)进行干预。潜在的策略包括:监测uNK细胞活性和GZMB水平作为预警指标;感染早期使用安全的抗炎药物阻断细胞因子风暴;针对IL-6、IL-17A、GZMB等关键因子开发特异性抗体或抑制剂等。
对于准妈妈而言,日常防护同样重要:备孕期接种流感等疫苗减少感染风险,保持健康饮食控制体重,通过正念训练缓解心理压力,避免接触空气污染物和重金属。这些措施虽不能完全消除风险,却能显著降低免疫激活的概率。
自闭症的发生是遗传与环境共同作用的结果,而孕期免疫激活正是环境因素中最具影响力的一环。随着研究的深入,未来我们或许能通过调节母体免疫状态,为每个胎儿筑起一道坚实的神经保护屏障,让更多孩子远离自闭症的困扰。
(作者:卞启武、魏海明、傅斌清)
参考文献
[1]HAN V X, PATEL S, JONES H F, DALE R C. Maternal immune activation and neuroinflammation in human neurodevelopmental disorders [J]. Nat Rev Neurol, 2021, 17(9): 564-79.
[2]KNUESEL I, CHICHA L, BRITSCHGI M, SCHOBEL S A, BODMER M, HELLINGS J A, TOOVEY S, PRINSSEN E P. Maternal immune activation and abnormal brain development across CNS disorders [J]. Nat Rev Neurol, 2014, 10(11): 643-60.
[3]ESTES M L, MCALLISTER A K. Maternal immune activation: Implications for neuropsychiatric disorders [J]. Science, 2016, 353(6301): 772-7.
[4]KWON H K, CHOI G B, HUH J R. Maternal inflammation and its ramifications on fetal neurodevelopment [J]. Trends Immunol, 2022, 43(3): 230-44.
[5]BIAN Q, CHEN Y, ZHANG J, DU X, ZHOU Y, ZHANG Q, DING C, WEI H, FU B. Maternal natural killer cells drive neuroimmune disorders in offspring through aberrant secretion of extracellular granzyme B [J]. Immunity, 2025, 58(6): 1502-18.e8.
[6]SHREEVE N, COLUCCI F. Mamma MIA! Decidual NK cells involved in fetal neurodevelopment [J]. Immunity, 2025, 58(6): 1364-6.
[7]USUI N, KOBAYASHI H, SHIMADA S. Neuroinflammation and Oxidative Stress in the Pathogenesis of Autism Spectrum Disorder [J]. International Journal of Molecular Sciences, 2023, 24(6).






