还记得你上一次感冒的情形吗?也许是发烧、咳嗽、全身酸痛,整个人昏昏沉沉,只想躺在床上。几天后,症状逐渐缓解,你恢复了活力。但奇怪的是,尽管身边还有不少人陆续“中招”,你却安然无恙,似乎已经具备了“抵抗力”。这是为什么?其实,在你上次与病毒的交锋中,你的免疫系统不仅成功打赢了这场战斗,还悄悄做了笔记,为未来可能的再战做好准备。这份“作战笔记”的一部分,就保存在一种特殊的免疫细胞中,它们叫作——记忆T细胞。
T细胞对病毒的杀伤可谓精准至极。狡猾的病毒常常通过不断改变表面的抗原结构来伪装自己,试图逃避免疫系统的识别。为了应对这种变化多端的敌人,T细胞在初次感染发生后,会通过基因重排这一机制,拼装出成千上万种不同的“钥匙”,只为排列组合出一种能够精确识别病毒抗原肽的T细胞受体(TCR),从而实现真正的“对症下药”。一旦筛选出对入侵病毒具有高亲和力的TCR,T细胞便在抗原肽的刺激下迅速增殖,发起对受感染细胞的精准打击,让病毒在体内无处藏身。
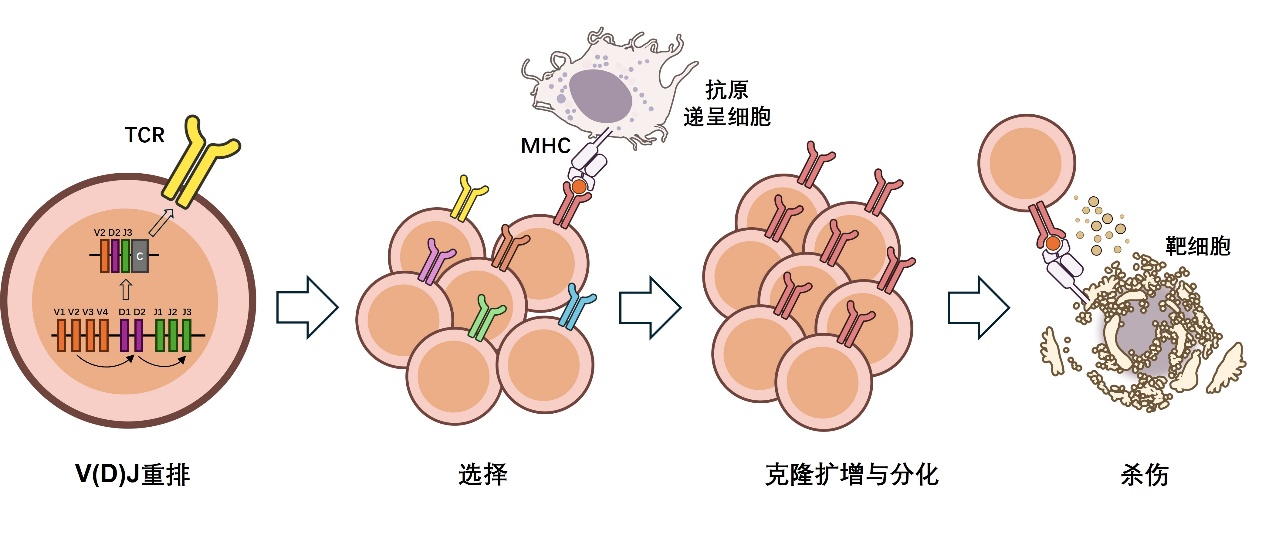
△T细胞在首次遇到病原体时启动免疫应答的过程
T细胞识别并清除“陌生敌人”的主要过程。首先,T细胞通过基因重排形成独特的受体(TCR),就像制作出独一无二的钥匙。接着,它们在胸腺中接受筛选,只留下能够识别“正确锁”(抗原肽-MHC复合物)的T细胞。在病原体入侵后,能够识别病原体的T细胞会快速增殖并转变为战斗状态,最终精准攻击被感染或异常的靶细胞(图片素材来自NIH Bioart素材库,下同)。
然而,随着病原体被逐步清除,炎症状态减弱,这些曾经奋勇杀敌的T细胞也开始凋亡,因为失去了持续的抗原刺激和必要的细胞因子支持。难道我们的身体会轻易放弃这些千挑万选才培养出的“免疫精英”吗?难道每次面对同一病原体时,都要重新经历一次耗时又高成本的T细胞筛选过程吗?当然不会。在初次感染中脱颖而出的那一批T细胞中,有一部分被保留下来,转化为记忆T细胞。这些“老兵”不但不会被清除,还能长期潜伏在体内,时刻准备应战。一旦病毒卷土重来,它们能够迅速做出反应,唤起机体的免疫记忆,让我们在不知不觉中再次战胜感染。

△病毒感染后T细胞的免疫应答和记忆形成
病原体入侵后,幼稚T细胞被激活,迅速增殖并分化为具有杀伤功能的效应T细胞。在病原体被成功清除后,大量效应T细胞会逐渐凋亡,这一阶段被称为“克隆收缩”。但少部分抗原特异性的T细胞会被保留下来,转变为记忆T细胞(图片改自Lam et al. Nat Rev Immunol 2024)。
与尚未接受免疫训练的幼稚T细胞相比,记忆T细胞对病原体的响应更快、更强,往往能在病原体尚未大量复制、形成稳定感染之前就将其迅速清除。这种快速反应能力,首先得益于记忆T细胞已经携带高亲和力的TCR,无需再经历缓慢而复杂的基因重排与筛选过程,大大节省了成熟和激活所需的时间。其次,记忆T细胞的表观遗传状态也发生了显著改变。与幼稚T细胞相比,它们编码多种免疫效应分子的基因处于更开放的状态,使得在TCR识别到抗原肽后,能更快地启动转录、翻译过程,快速表达关键蛋白,为战斗做好准备。此外,记忆T细胞还表现出更高的“战斗意愿”。它们表达更多的黏附分子,增强与抗原递呈细胞的结合力,使其即便在较低的抗原信号强度下也能被激活。甚至,部分记忆T细胞可以在缺乏CD28共刺激信号的条件下被激活,这在幼稚T细胞中是无法实现的。正是由于这些特征,记忆T细胞具备了在低抗原负荷下迅速启动免疫应答的能力,像隐形的卫士一样,为我们构筑起一道牢不可破的防线,有效预防感染的再次发生。
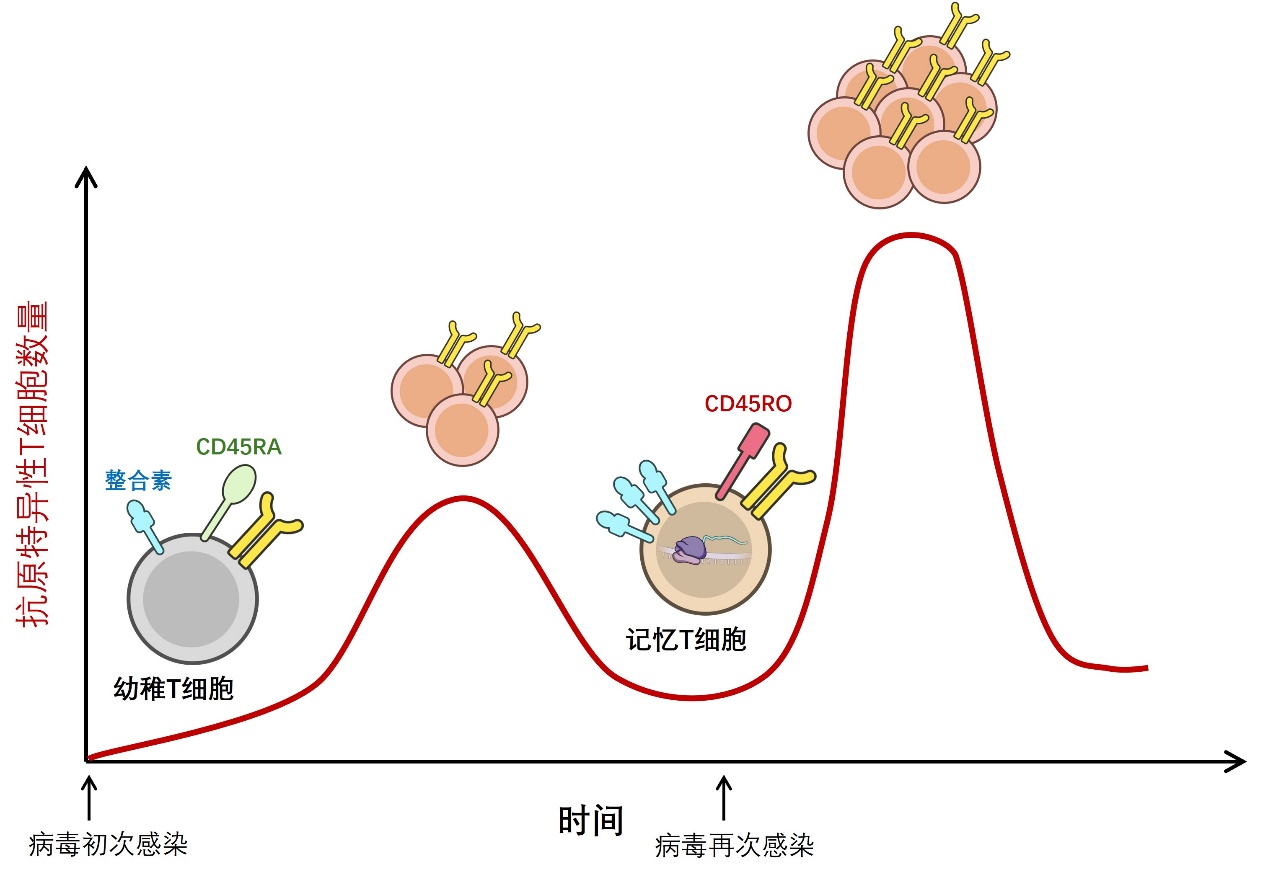
△初次与再次感染T细胞免疫应答的差异
与幼稚T细胞相比,记忆T细胞表达更多黏附分子(如整合素),并具有更高的效应基因开放程度。这使它们更容易被激活,启动免疫反应的“门槛”更低,因此在再次遭遇病毒时,能更快、更强地发起免疫应答。
记忆T细胞的另一个显著特点是寿命更长。在接种天花疫苗75年后,科学家仍能在部分接种者的血液中检测到针对痘苗病毒的特异性记忆T细胞,显示出其惊人的持久性。那么,在缺乏抗原刺激的漫长岁月中,我们的机体是如何维持这些记忆T细胞的存在的呢?简单来说,外部细胞因子信号和内部代谢调控共同构成了记忆T细胞长久存活的保障机制。在外因方面,白介素-7(IL-7)和白介素-15(IL-15)起着关键作用。IL-7通过诱导抗凋亡蛋白Bcl-2的表达,促进记忆T细胞的生存;而记忆T细胞因表达较高水平的IL-7受体α(CD127),因此对IL-7信号更为敏感。IL-15则主要维持记忆T细胞的缓慢增殖,以补偿自然凋亡带来的损失,从而保持总体数量的稳定。在内因方面,代谢重编程赋予了记忆T细胞更强的能量调控能力。与依赖糖酵解获取快速能量的效应T细胞不同,记忆T细胞主要通过线粒体氧化磷酸化产能,这种方式虽然速度较慢,但效率更高,更适合长期存活。此外,记忆T细胞还通过水通道蛋白AQP9摄取甘油用于脂肪合成与储存,同时积累糖原,以便在漫长的“休眠期”中提供稳定能量。通过这些“开源节流”的策略,记忆T细胞不仅提高了能量利用效率,还为自身建立起一套稳健的能量储备系统,从而实现在缺乏抗原刺激的环境下长期存活并维持免疫保护力。

△细胞因子对记忆T细胞生存和代谢重编程的影响
IL-7和IL-15是维持记忆T细胞生存的关键细胞因子。IL-7发挥抗凋亡作用,并促进甘油通道蛋白AQP9的表达,帮助记忆T细胞储备脂肪作为备用能源。IL-15不仅促进记忆T细胞的增殖,还诱导其高表达胞浆型磷酸烯醇式丙酮酸羧激酶(PCK1),从而推动6-磷酸葡萄糖的生成,为糖原合成提供原料。
虽然记忆T细胞整体上展现出“快速响应”和“长寿命”的优势,但它们并不是千篇一律的“克隆士兵”,而是分布在人体不同部位、各司其职,组成了一个层次分明、协同作战的免疫防线。其中,一类被称为中枢记忆T细胞(Tcm),主要驻扎在淋巴结等免疫器官中,犹如“预备役部队”。虽然它们的响应速度相对较慢,但具备强大的增殖能力,一旦感染再次发生,便可源源不断地产生大量新兵投入战斗。同时,Tcm的寿命也更为持久,是记忆T细胞中维持时间较长的一类。另一类是效应记忆T细胞(Tem),它们在血液、淋巴和外周组织中巡逻,就像灵活机动的“快速反应部队”。一旦病原体突破屏障、进入循环系统,Tem细胞便可立即识别并发动攻击,成为最早应对病原体感染的记忆T细胞。此外,还有一群“原地待命、
离岗位”的哨兵——组织驻留记忆T细胞(Trm)。它们长期驻守在皮肤、肺、肠道等容易遭受感染的外围组织,如同边境线上的常驻守卫。一旦病毒从这些门户潜入,Trm细胞会第一时间发出警报并直接发起局部反击,为整个免疫系统争取宝贵的反应时间;同时,它们还能分泌像IL-10这样的调节分子,帮助控制炎症反应,避免免疫系统“反应过头”,对局部组织造成伤害。正是由于这三类记忆T细胞分布广泛、配合紧密,我们的身体才能在熟悉的病原体再次来袭时,迅速识别、高效应对,从而防患于未然,构建起坚固的免疫记忆屏障。
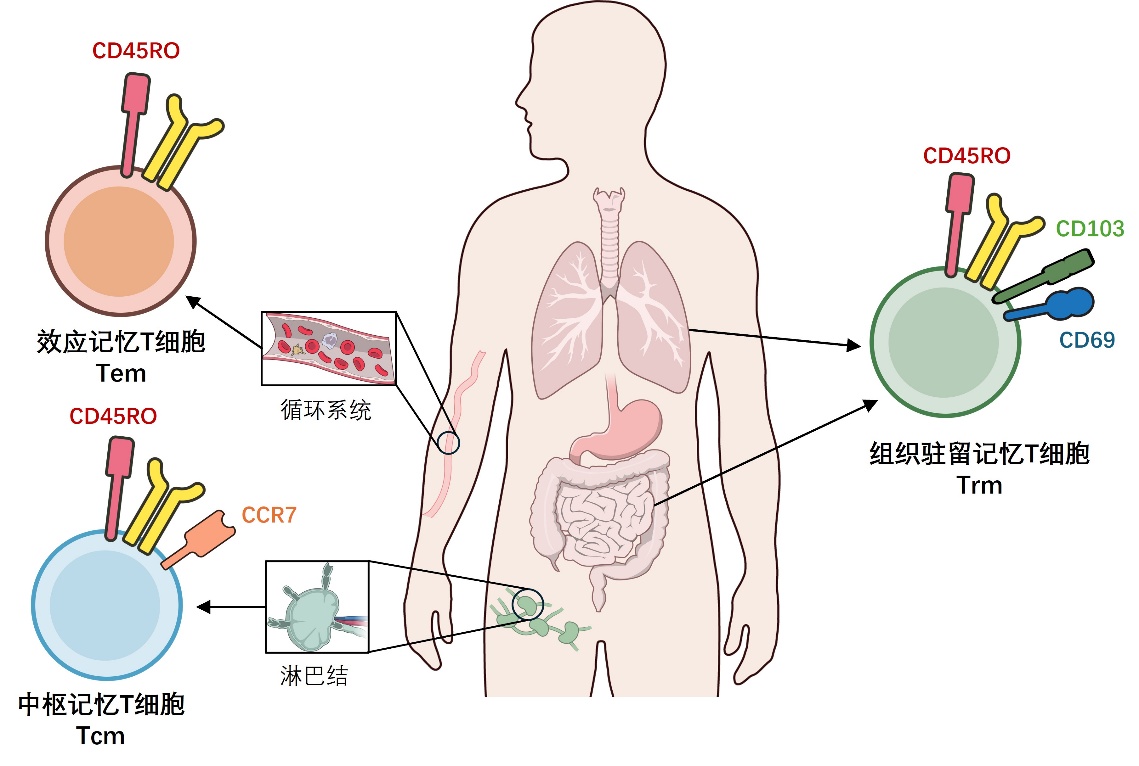
△三种记忆T细胞亚群的主要分布位置及标志物
记忆T细胞主要分为三大“兵种”,分别驻扎在身体的不同层次的“防线”上。它们各自携带独特的表面分子标志,成为免疫学家识别其身份和功能的关键 “名牌”。
随着我们对记忆T细胞的认识不断深入,未来有望主动“操控”免疫记忆,为多种疾病带来更有效的预防和治疗手段。其中一个最引人注目的应用方向,就是开发T细胞疫苗,以增强对病毒感染的防护。目前,大多数疫苗的设计重点是激活B细胞产生成抗体,这些抗体能够识别病毒表面的特定表位,从而中和病毒。然而,病毒常常通过突变这些表位来“变装”,让疫苗的保护效力随着时间减弱甚至失效。相比之下,T细胞则可以识别病毒内部的“核心零件”,这些部分更加难以突变。因此,一旦我们对记忆T细胞的激活机制掌握得更充分,就可以设计出靶向这些保守区域的T细胞疫苗,提供更持久、更广谱的免疫保护。更进一步,科学家还希望将疫苗直接接种在病毒最容易入侵的部位,比如呼吸道或皮肤,通过诱导局部Trm的生成,在病毒入侵第一道关口就构建起一支常驻的“防御哨兵”,实现快速、精准的免疫反应。除了感染性疾病,肿瘤免疫治疗也是记忆T细胞研究的另一个前沿领域。在急性感染中,记忆T细胞通常在病原体被清除后形成;但在肿瘤这样长期存在的敌人面前,T细胞往往难以形成有效记忆,反而在抗原的持续刺激下陷入“筋疲力尽”的耗竭状态。同时,肿瘤微环境中免疫抑制信号、缺氧以及营养匮乏等因素,也会进一步妨碍记忆T细胞的产生与维持。然而,越来越多的研究发现,记忆T细胞,尤其是Trm细胞,在监视肿瘤、抑制转移、清除残余癌细胞中起着关键作用。如果我们能够找到合适的方法,在肿瘤环境中成功诱导出针对肿瘤抗原的免疫记忆,将为癌症的治疗和预防提供全新的突破口。
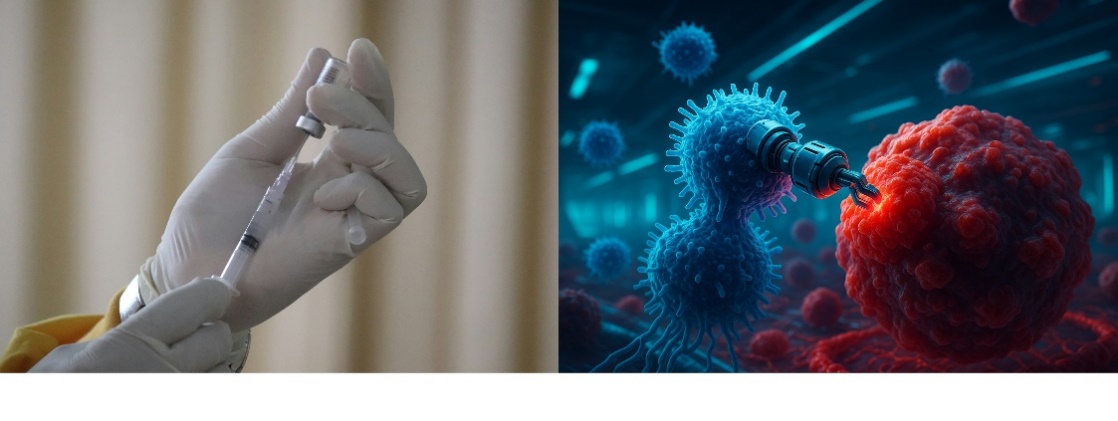
△T细胞免疫记忆的应用前景:疫苗的改进与肿瘤免疫疗法
深入研究记忆T细胞,有望为未来T细胞疫苗的设计(左图,图片来自网络)和癌症细胞疗法的优化(右图,图片来自AI生成)带来突破,提升我们对感染和肿瘤等疾病的防控能力。
记忆T细胞是我们身体里不动声色却无比高效的“老兵”,它们凭借快速反应、超长寿命和灵活部署,为我们构筑起坚固的免疫防线。无论是病毒的反复侵袭,还是肿瘤细胞的潜藏威胁,它们始终默默守护在第一线。随着科学家对其机制的不断揭示,我们不仅更加理解了自身免疫系统的聪明与强大,也看到了未来疫苗设计和肿瘤免疫治疗的新方向。在这个病原体传播迅速、变异频繁的时代,唤醒并善用体内这支“记忆部队”,也许正是我们赢得健康未来的关键。
作者:申奕洋 王健羽
参考文献
[1]ARAKI Y, WANG Z, ZANG C, et al. Genome-wide analysis of histone methylation reveals chromatin state-based regulation of gene transcription and function of memory CD8+ T cells [J]. Immunity, 2009, 30(6): 912-25.
[2]LAM N, LEE Y, FARBER D L. A guide to adaptive immune memory [J]. Nature Reviews Immunology, 2024, 24(11): 810-29.
[3]FAHMY T M, BIELER J G, EDIDIN M, SCHNECK J P. Increased TCR avidity after T cell activation: a mechanism for sensing low-density antigen [J]. Immunity, 2001, 14(2): 135-43.
[4]CROFT M, BRADLEY L M, SWAIN S L. Naive versus memory CD4 T cell response to antigen. Memory cells are less dependent on accessory cell costimulation and can respond to many antigen-presenting cell types including resting B cells [J]. The journal of immunology, 1994, 152(6): 2675-85.
[5]KAECH S M, TAN J T, WHERRY E J, et al. Selective expression of the interleukin 7 receptor identifies effector CD8 T cells that give rise to long-lived memory cells [J]. Nature immunology, 2003, 4(12): 1191-8.
[6]NOLZ J C, RICHER M J. Control of memory CD8(+) T cell longevity and effector functions by IL-15 [J]. Mol Immunol, 2020, 117: 180-8.
[7]CUI G, STARON M M, GRAY S M, et al. IL-7-Induced Glycerol Transport and TAG Synthesis Promotes Memory CD8+ T Cell Longevity [J]. Cell, 2015, 161(4): 750-61.
[8]MA R, JI T, ZHANG H, et al. A Pck1-directed glycogen metabolic program regulates formation and maintenance of memory CD8+ T cells [J]. Nature Cell Biology, 2018, 20(1): 21-7.
[9]FARBER D L, YUDANIN N A, RESTIFO N P. Human memory T cells: generation, compartmentalization and homeostasis [J]. Nature Reviews Immunology, 2014, 14(1): 24-35.
[10]GAVIL N V, CHENG K, MASOPUST D. Resident memory T cells and cancer [J]. Immunity, 2024, 57(8): 1734-51.






