每年的4月11日被定为“世界帕金森病日”。帕金森病(Parkinson’s disease, PD)是一种常见于中老年的中枢神经系统退行性疾病,临床上以静止性震颤、运动迟缓、肌强直和姿势平衡为主要特征,其病理表现为黑质致密部多巴胺神经元的损伤和Lewy小体的形成。[1,2]
图片来源:站酷海洛
PD的发病原因非常复杂,至今仍不清楚。大部分帕金森病患者为散发病例,仅有不到10%的患者有家族史,遗传因素、环境因素、衰老、氧化应激等被认为是PD的重要诱发原因。[3]
理想的PD研究动物模型应具备以下特征:可以检测到PD的行为学异常,随着年龄发展有选择性和渐进性多巴胺神经元损伤,有Lewy小体形成。但是帕金森病症状的复杂性以及机制的复杂性也导致动物模型的多样性,目前不同的动物模型只能模拟部分的症状。
今天主要介绍2个常用的动物模型:MPTP诱导的小鼠模型和SNCA转基因小鼠模型。
MPTP诱导的小鼠模型
MPTP诱导的小鼠模型是一种较为常用的神经毒素诱导模型。利用神经毒素可以建立与人类PD类似并且部分反映人类PD病理特征的动物模型,可以为PD治疗药物筛选以及机制研究提供良好途径,在PD诱导模型中,常用的神经毒素包括MPTP、6-OHDA、百草枯、鱼藤酮等药物。
而MPTP诱导的小鼠模型建模周期短(1-2周),操作简单,可以直接采用腹腔注射或者皮下注射,并且神经元缺失明显以及行为学检测异常显著,是目前最为常用的PD动物模型之一。
MPTP(1-甲基-4-苯基-1,2,3,6-四氢吡啶)有高度脂溶性,易透过血脑屏障,进入脑后可在神经胶质细胞单胺氧化酶的作用下转化为它的有效成分MPP+。MPP+被多巴胺转运体摄取到多巴胺能神经元线粒体内后,可抑制线粒体复合物I的活性,会导致多巴胺能神经元变性、死亡。
MPTP的毒性作用存在种属差异,小鼠较为敏感,而大鼠有一定耐受性,因此常用MPTP诱导的小鼠模型。
MPTP诱导的小鼠模型分为多巴胺神经元急性损伤模型和慢性损伤模型。急性损伤模型会出现快且严重的神经元损伤,并且有明显的行为学异常,但是无α-synuclein聚集MPP+ [4]。不过慢性损伤模型虽有α-synuclein聚集,但神经元损伤以及行为学异常不显著。[5]
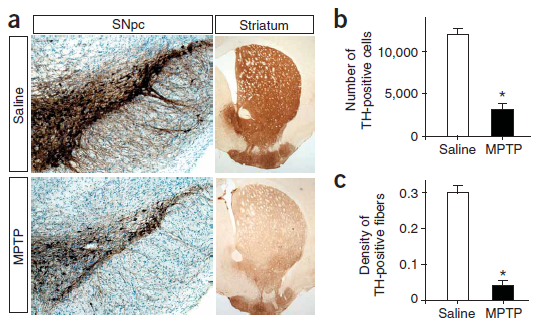
Figure 1. Immunostaining of tyrosine hydroxylase (TH)–positive neurons in the substantia nigra pars compacta (SNpc) and terminals in the striatum.[4]
更多MPTP诱导的实验细节,可参考以下文献:
Jackson-Lewis V, Przedborski S. Protocol for the MPTP mouse model of Parkinson’s disease. Nat Protoc. 2007;2(1):141–51.
 Protocol for the MPTP mouse model of PD.pdf
Protocol for the MPTP mouse model of PD.pdf
SNCA转基因小鼠模型
SNCA转基因小鼠模型是一种较为常用的PD遗传基因动物模型。PD遗传基因动物模型包括过表达基因模型、基因敲除以及基因突变模型等。PD遗传基因模型一般在病理特征、发病特点上和症状表现上均与人类的PD有较高的一致性,是新药开发和药物筛选的良好模型。
目前已经用于动物模型的帕金森相关基因包括:SNCA、PINK1、LRRK2、DJ-1,PRKN等。
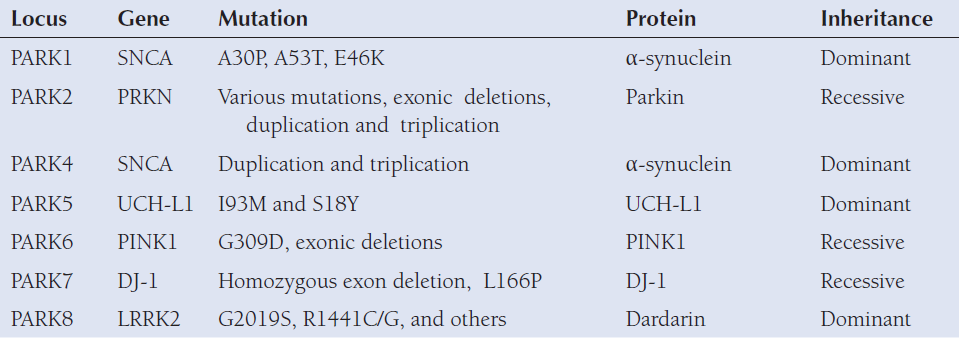
Table1: Summary of familial PD mutations that have been replicated in animal models[5]
SNCA是第一个被发现与PD相关的常染色体显性基因(即PARK1和PARK4),其编码的α-synuclein蛋白是一种存在于中枢神经系统神经突触末端的可溶性蛋白,是Lewy小体的重要组成部分。
研究发现在家族遗传性帕金森病中存在有3种突变(A53T,A30P和E46K)和其野生型二倍体的表达,SNCA点突变或者二倍体都会导致α-synuclein蛋白聚集成Lewy小体,阻碍了多巴胺的代谢和神经元的正常功能,导致神经元的死亡。[6]
Prnp-SNCA*A53T基因过表达小鼠是过表达包含A53T突变的人源SNCA cDNA,启动子为小鼠的Prnp启动子。在Prnp-SNCA*A53T转基因小鼠品系筛选过程中,发现其中1个line的后代纯合子小鼠从8-9个月开始部分逐渐出现行为学检测异常,以及弓背,在14-15个月时,大部分小鼠都出现不同程度的行为学检测异常。[7]
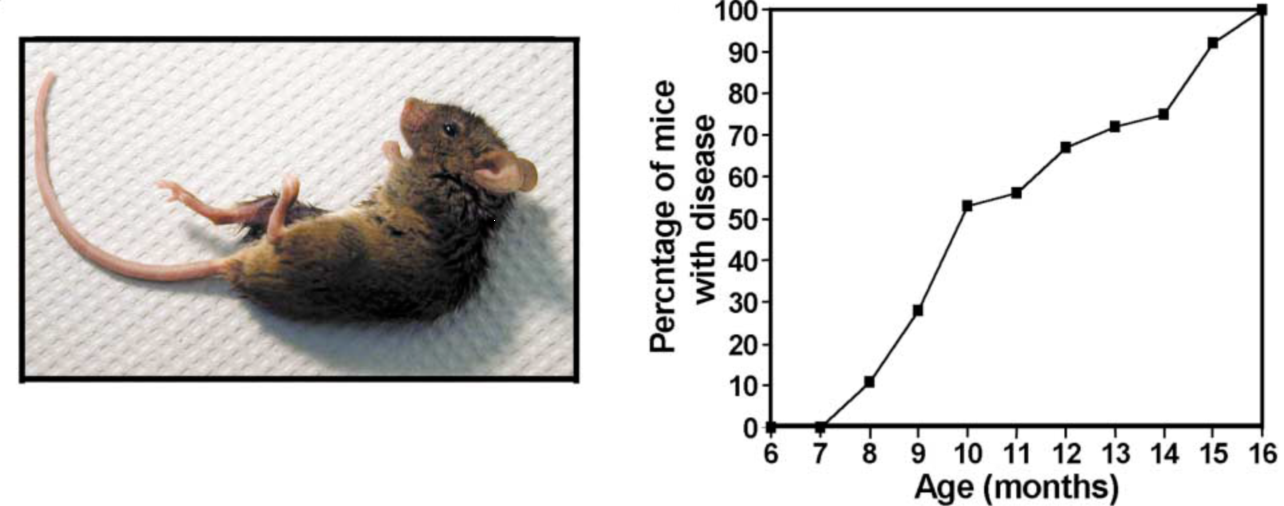
Figure 2. Tg Lines Expressing Human-Syn Driven by the Murine PrP Promoter and Motor Impairment(Rota-Rod) Due to A53T Pathological Mutant[7]
免疫组化分析显示,在该品系小鼠中能检测到α-synuclein包涵体广泛分布,在脊髓、脑干、小脑和丘脑中都有密集聚集。[7]
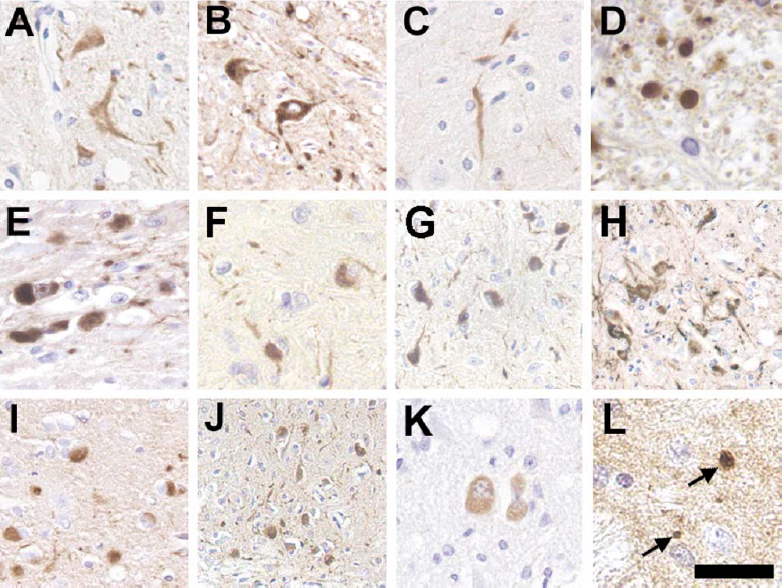
Figure 3. Representative -Syn Pathology in Neuronal Cell Bodies and Processes[7]
免疫电镜和生化分析也表明,神经元内含物主要由10-16nm的α-synuclein原纤维构成。该品系小鼠体内包涵体的组成和位置与人类神经元α-synuclein聚集有一定相似性,并且形态变化以及行为学异常发展具有一定的进展性,和人类的发病过程也更相似,因此常用于α-synuclein的聚集研究以及家族性帕金森病研究。[7]
更多PD遗传基因动物模型描述,可查看以下文献:
https://www.ncbi.nlm.nih.gov/pubmed/30702844
 Parkinson’s Disease-Book.pdf
Parkinson’s Disease-Book.pdf
南模生物相关服务
南模生物助力帕金森病研究,可提供帕金森病研究相关的小鼠模型以及相关实验服务。
帕金森病相关靶点基因的基因修饰小鼠模型
品系简称 | 对应人源基因 | 状态 |
Snca-KO | SNCA | 可售 |
Lrrk2-KO | LRRK2 | 可售 |
Park2-KO | PRKN | 可售 |
Park7-KO | DJ-1 | 可售 |
Pink1-KO | PINK1 | 可售 |
更多模型可详询 | ||
MPTP诱导的小鼠模型
原理:药物MPTP可破坏小鼠大脑纹状体与黑质间的多巴胺通路来模拟人类的帕金森病。
样本要求:雄性C57小鼠10周龄
服务周期:14个工作日
神经学行为实验分析
实验名称 | 适应症 | |
体重 | Body,Weight | 基本情况、抑郁 |
摄食量 | Food Intake | 基本情况、抑郁 |
摄水量 | Water Intake | 基本情况、抑郁 |
旷场活动 | Open Field | 基本情况、抑郁、焦虑、认知障碍 |
高架十字 | Elevated Plus Maze | 焦虑、 |
悬尾 | TailL Suspension | 焦虑、抑郁 |
爬杆 | Pole test | 焦虑、平衡和运动障碍 |
新物体识别 | NORT | 学习记忆能力问题 |
避暗实验 | Passive Avoidance | 学习记忆能力问题 |
避暗实验 | Passive Avoidance | 长期记忆 |
Y迷宫 | Ymaze | 学习记忆能力问题 |
水迷宫 | MWM | 学习记忆能力问题 |
跑步机 | Treadmill | 平衡、运动能力 |
疲劳转棒 | Rotarod Test | 平衡、运动能力 |
平衡木 | Balance Beam Test | 平衡、运动能力 |
甩尾 | Tail - Flick Test | 痛觉障碍 |
热板 | Hot Plate Test | 痛觉障碍 |
机械痛 | Plantar Von Frey | 触觉障碍 |
2020年客户已发表PD研究文章:
1. Zhang W, Zhou M, Lu W, et al. CNTNAP4 deficiency in dopaminergic neurons initiates parkinsonian phenotypes[J]. Theranostics, 2020, 10(7): 3000.
2. Wang Z, Dong H, Wang J, et al. Pro-survival and anti-inflammatory roles of NF-κB c-Rel in the Parkinson's disease models[J]. Redox Biology, 2020: 101427.
3. Li H, Liu Z, Wu Y, et al. The deficiency of NRSF/REST enhances the pro-inflammatory function of astrocytes in a model of Parkinson's disease[J]. Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease, 2020, 1866(1): 165590.
4. Dong J, Liu X, Wang Y, et al. Nurr1Cd11-Cre conditional knockout mice display inflammatory injury to nigrostriatal dopaminergic neurons[J]. Glia, 2020.
参考文献
[1]Spillantini MG, Schmidt ML, Lee VM, et al. Alpha-synuclein in Lewy bodies[J]. Nature.
1997,388(6645):839-40.
[2]Gandhi S, Wood NW. Molecular pathogenesis of Parkinson's disease[J]. Human molecular genetics.2005,14(18):2749-55.
[3]Sherer TB, Betarbet R, Greenamyre JT. Environment, mitochondria, and Parkinson's disease[J]. The Neuroscientist : a review journal bringing neurobiology, neurology and psychiatry. 2002,8(3):192-7.
[4]Jackson-Lewis V, Przedborski S. Protocol for the MPTP mouse model of Parkinson’s disease. Nat Protoc. 2007;2(1):141–51.
[5]Stoker TB1, Greenland JC1, editors. Parkinson’s Disease: Pathogenesis and Clinical Aspects [Internet]. Brisbane (AU): Codon Publications; 2018 Dec. Chapter 5.
[6]http://omim.org/entry/163890?search=SNCA&highlight=snca
[7]Giasson BI, Duda JE, Quinn SM, et al. Neuronal alpha-synucleinopathy with severe movement disorder in mice expressing A53T human alpha-synuclein. Neuron 2002, 34(4):521-33






