上周,一年一度的ASCO(美国临床肿瘤学会)年会在美国芝加哥落下帷幕。在今年的大会中,如果说必须得选出一个闪耀之星来,阿斯利康和第一三共的重磅抗体偶联药物(ADC)Enhertu,当仁不让。该药在治疗HER2低表达的不可切除或转移性乳腺癌患者的3期临床试验中,与化疗相比,将疾病进展或死亡风险降低50%。 图1 Enhertu的临床研究发表在新英格兰医学杂志
图1 Enhertu的临床研究发表在新英格兰医学杂志
Enhertu的横空出世让世界的目光再次聚集到乳腺癌上。乳腺癌是世界上女性中最常见,也是导致女性死亡最常见的癌症类型。尽管目前乳腺癌患者的5年生存率可达90%,然而5年生存率≠治愈率,晚期乳腺癌几乎不可治愈,患者治疗仍有很大提升空间。本文将从乳腺癌发病机制、乳腺癌分型以及治疗靶点三个方面介绍乳腺癌研究概况,希望能给大家带来一些帮助和启迪。
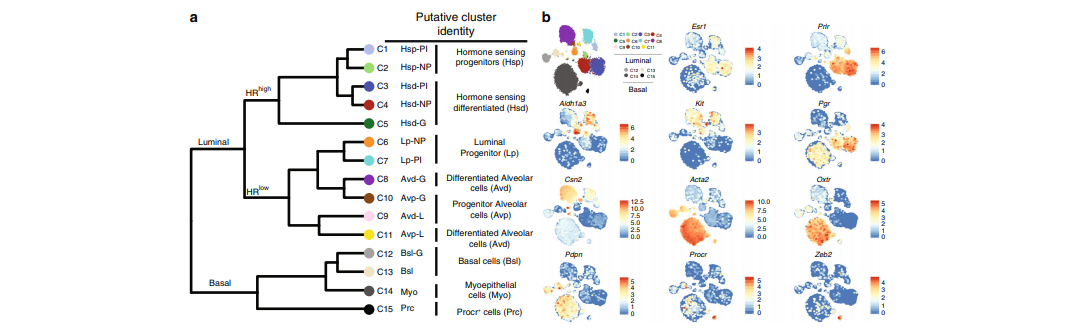 图2 乳腺上皮细胞分群[1]
图2 乳腺上皮细胞分群[1]
其中管腔细胞类型可分为两大的细胞亚群,C1-C5表现出hormone-sensing细胞(Hs)特征,例如激素受体(Pgr, Esr1, Prlr)表达水平高;C6-C11则表达较低的激素受体。而基底细胞类型中,C14表现出肌上皮细胞特征,C15表现出Procr+基底细胞特征,与乳腺再生有关[1]。
南模生物可提供多种乳腺上皮细胞Cre/Dre工具鼠,助力在乳腺领域的研究项目。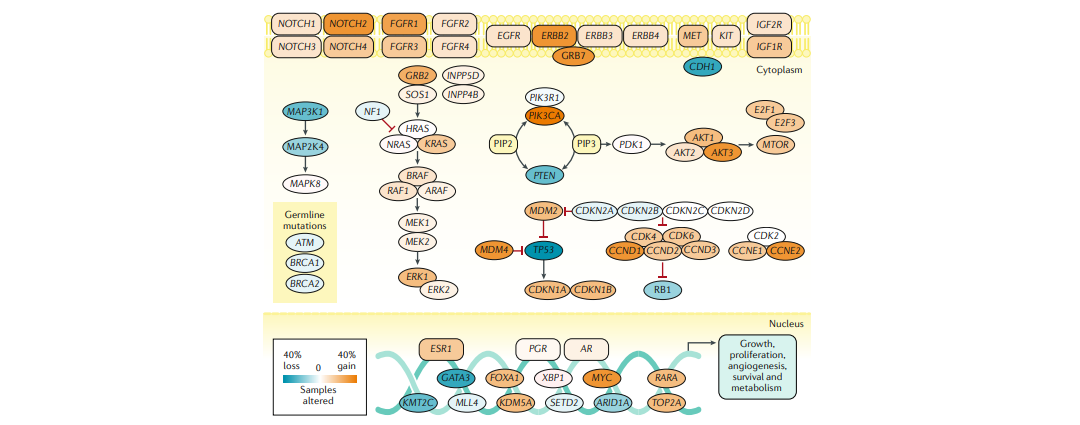 图3 乳腺癌的分子突变[2](橙色表示功能获得突变,蓝色表示功能缺失突变)
图3 乳腺癌的分子突变[2](橙色表示功能获得突变,蓝色表示功能缺失突变)
表观遗传学改变也与乳腺癌的发生和发展息息相关。在乳腺癌中,基因会发生总体高甲基化(导致基因激活、癌基因上调和染色体不稳定),或局部(位点特异性)高甲基化(由于DNA修复基因的沉默导致基因抑制和遗传不稳定),这种情况发生的几率较低。其他表观遗传机制包括DNA甲基化修饰组蛋白尾部、染色质结构改变以沉默基因表达和核小体重构。这些变化是可逆的、由酶介导的,并且具有成为靶标的潜力[3]。
在科研工作中,利用基因工程手段,引入突变基因,可建立乳腺癌自发肿瘤或诱导生成肿瘤小鼠模型,进而探究乳腺癌发生或转移的内在机理。目前主流的原发瘤模型分为自发型乳腺癌模型、诱导型乳腺癌模型和基因工程小鼠乳腺癌模型,具体模型的情况可见《疾病小鼠模型系列之乳腺癌篇》。
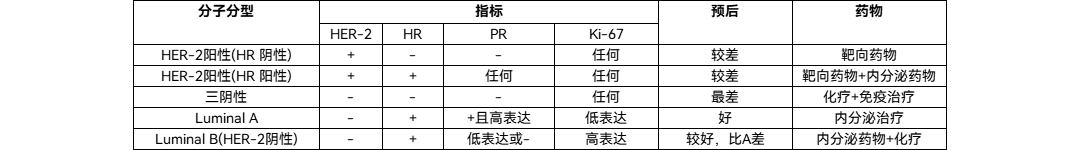
根据2020年CSCO(中国临床肿瘤学会)乳腺癌指南,乳腺癌可根据分子分型[HR(雌激素受体)、PR(孕激素受体)、HER-2(人表皮生长因子受体-2)、Ki-67(细胞周期蛋白)分为五类,不同分子分型决定了系统治疗方案的差异。乳腺癌分子分型如下:
雌激素受体α(ERα)在大约70%的浸润性乳腺癌中表达。激素孕酮受体(PR)的表达也是ERα信号的标志。雌激素受体(ER)或PR在至少1%的肿瘤细胞中的表达被归类为HR+,使用内分泌药物下调ER信号是ER阳性或PR阳性乳腺癌的主要系统治疗方法。而对于转移性患者来说目前的一线标准疗法为CDK4/6抑制剂与激素疗法联用。细胞周期蛋白依赖性激酶(cyclin dependent kinases,CDKs)在细胞周期的启动和各个时期的转换调节中发挥重要作用。因癌细胞的基因改变而导致CDK4/6过度活化的表现存在于多个癌种之中,抑制CDK4/6的功能可以阻断癌细胞的有丝分裂过程,还能促进免疫系统攻击癌细胞。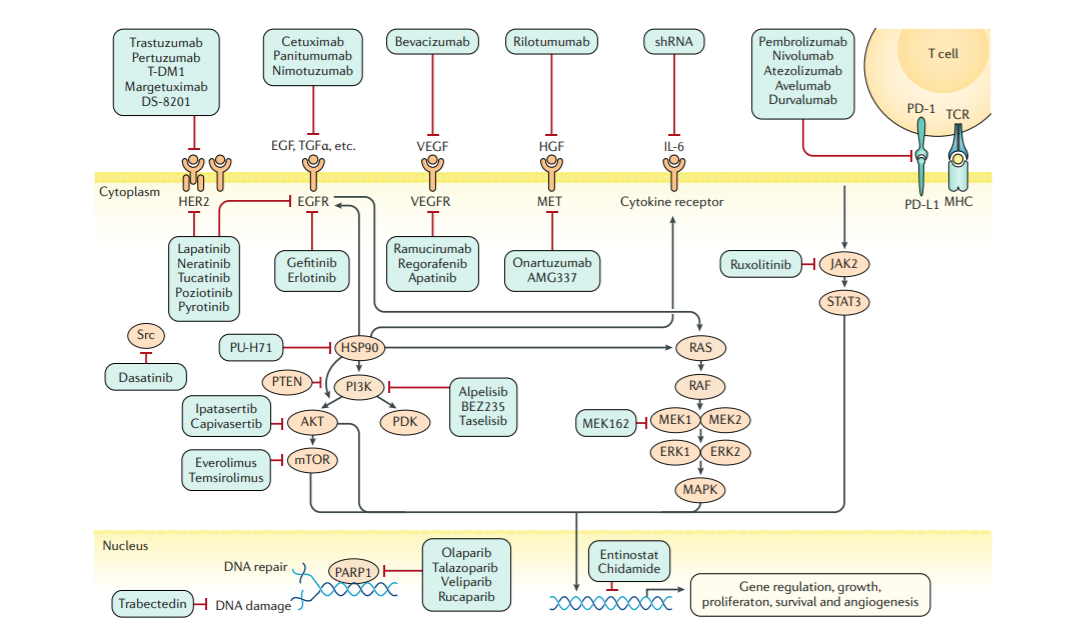 图4 乳腺癌新出现的靶向途径及药物[2]ERBB2+靶向治疗的发展是乳腺癌治疗中最重要的进展之一。表皮生长因子2(ERBB2,以前称为HER2或HER2/neu),在大约20%的乳腺癌中被扩增或过度表达。具有ERBB2扩增或过度表达的肿瘤是ERBB2阳性,这类乳腺癌的患者受益于ERBB2靶向治疗,包括抗ERBB2抗体(例如曲妥珠单抗和pertuzumab)和小分子酪氨酸激酶抑制剂(lapatinib and neratinib)。Enhertu对低水平HER2乳腺癌患者仍有良好的疗效。
图4 乳腺癌新出现的靶向途径及药物[2]ERBB2+靶向治疗的发展是乳腺癌治疗中最重要的进展之一。表皮生长因子2(ERBB2,以前称为HER2或HER2/neu),在大约20%的乳腺癌中被扩增或过度表达。具有ERBB2扩增或过度表达的肿瘤是ERBB2阳性,这类乳腺癌的患者受益于ERBB2靶向治疗,包括抗ERBB2抗体(例如曲妥珠单抗和pertuzumab)和小分子酪氨酸激酶抑制剂(lapatinib and neratinib)。Enhertu对低水平HER2乳腺癌患者仍有良好的疗效。
三阴性乳腺癌约占所有乳腺肿瘤的15%,以缺乏分子靶点ER、PR或ERBB2的表达为特征,化疗为其主要治疗手段。不过近年来这一领域屡有突破。部分患者高表达EGFR、BRCA1/2、VEGF、FGFR,可通过设计靶向这些位点的单克隆抗体抑制肿瘤生长。TROP2是一种I型跨膜糖蛋白,在细胞迁移、增殖、细胞周期进展和转移中发挥重要作用,在乳腺癌、肺癌等人类上皮癌中表达更高,这使TROP2在乳腺癌治疗领域成为了一个很好的靶点。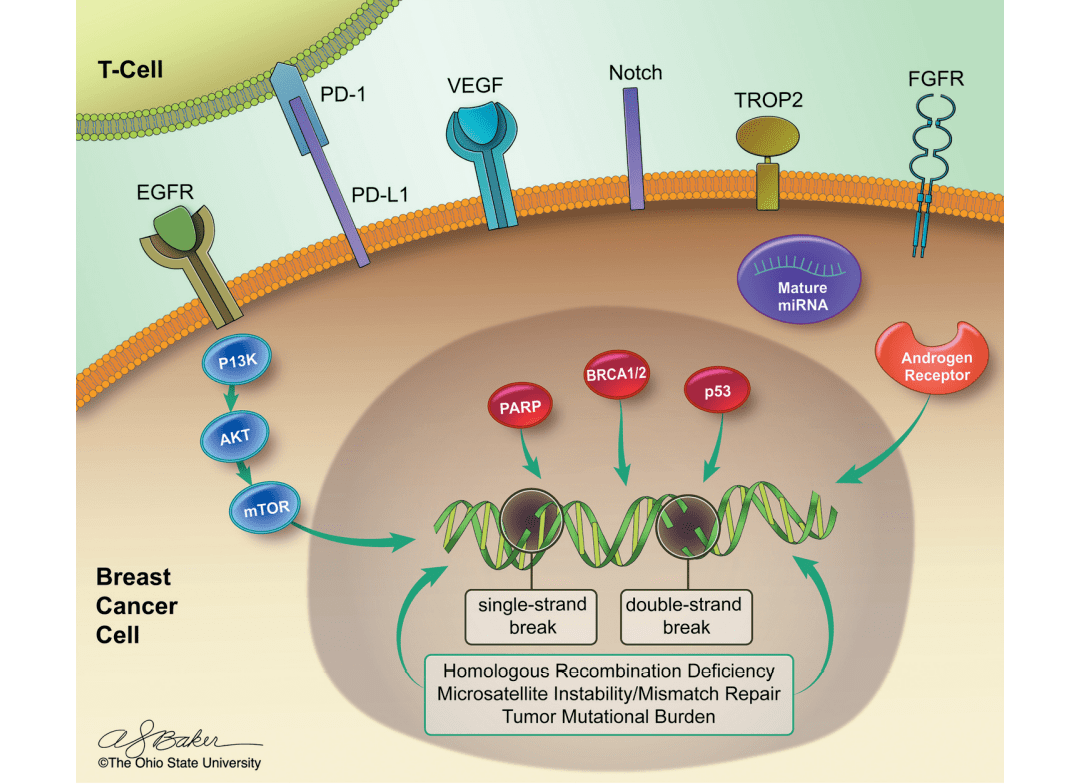 图5 三阴性乳腺癌信号转导与肿瘤发生的关键机制[5]
图5 三阴性乳腺癌信号转导与肿瘤发生的关键机制[5]
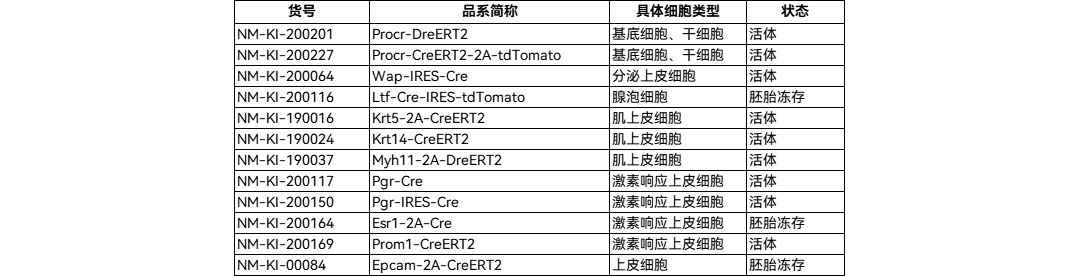
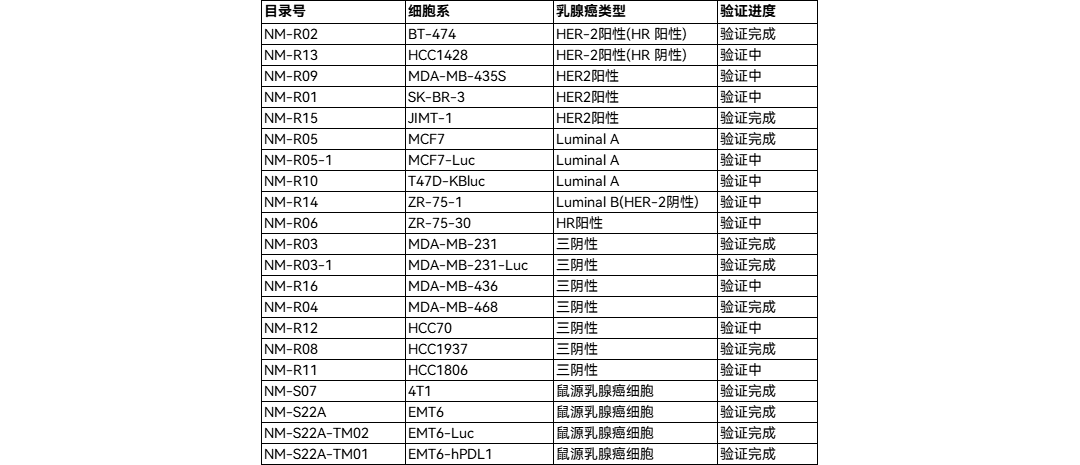
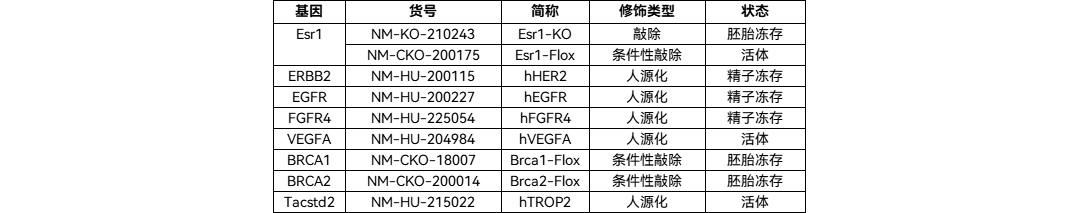
南模生物可提供多种基因修饰小鼠,可用于靶点功能研究及模型开发探索,详见下表:
 图1 Enhertu的临床研究发表在新英格兰医学杂志
图1 Enhertu的临床研究发表在新英格兰医学杂志Enhertu的横空出世让世界的目光再次聚集到乳腺癌上。乳腺癌是世界上女性中最常见,也是导致女性死亡最常见的癌症类型。尽管目前乳腺癌患者的5年生存率可达90%,然而5年生存率≠治愈率,晚期乳腺癌几乎不可治愈,患者治疗仍有很大提升空间。本文将从乳腺癌发病机制、乳腺癌分型以及治疗靶点三个方面介绍乳腺癌研究概况,希望能给大家带来一些帮助和启迪。
01
乳腺癌发病机制
1
乳腺上皮细胞分类
 图2 乳腺上皮细胞分群[1]
图2 乳腺上皮细胞分群[1]其中管腔细胞类型可分为两大的细胞亚群,C1-C5表现出hormone-sensing细胞(Hs)特征,例如激素受体(Pgr, Esr1, Prlr)表达水平高;C6-C11则表达较低的激素受体。而基底细胞类型中,C14表现出肌上皮细胞特征,C15表现出Procr+基底细胞特征,与乳腺再生有关[1]。
南模生物可提供多种乳腺上皮细胞Cre/Dre工具鼠,助力在乳腺领域的研究项目。
2
乳腺癌发生分子机制[2]
乳腺上皮细胞在多种致癌因子的作用下,将发生增殖失控,造成肿瘤发生。肿瘤细胞中最常见的突变和/或扩增基因是TP53(肿瘤的41%),PIK3CA (30%),MYC (20%),PTEN(16%),CCND1(16%),ERBB2 (13%),FGFR1(11%)和GATA3(10%) (图2)。这些编码细胞周期调节的基因,要么被抑制(如p53),要么被激活(如cyclin D1),维持细胞增殖和/或抑制细胞凋亡。大多数乳腺癌是由多个累积作用的低渗透突变引起的。Luminal A肿瘤中PIK3CA突变发生率高(49%),而TP53突变发生率高是基底样肿瘤的标志(84%)。
 图3 乳腺癌的分子突变[2](橙色表示功能获得突变,蓝色表示功能缺失突变)
图3 乳腺癌的分子突变[2](橙色表示功能获得突变,蓝色表示功能缺失突变)表观遗传学改变也与乳腺癌的发生和发展息息相关。在乳腺癌中,基因会发生总体高甲基化(导致基因激活、癌基因上调和染色体不稳定),或局部(位点特异性)高甲基化(由于DNA修复基因的沉默导致基因抑制和遗传不稳定),这种情况发生的几率较低。其他表观遗传机制包括DNA甲基化修饰组蛋白尾部、染色质结构改变以沉默基因表达和核小体重构。这些变化是可逆的、由酶介导的,并且具有成为靶标的潜力[3]。
在科研工作中,利用基因工程手段,引入突变基因,可建立乳腺癌自发肿瘤或诱导生成肿瘤小鼠模型,进而探究乳腺癌发生或转移的内在机理。目前主流的原发瘤模型分为自发型乳腺癌模型、诱导型乳腺癌模型和基因工程小鼠乳腺癌模型,具体模型的情况可见《疾病小鼠模型系列之乳腺癌篇》。
02
乳腺癌分型
根据2020年CSCO(中国临床肿瘤学会)乳腺癌指南,乳腺癌可根据分子分型[HR(雌激素受体)、PR(孕激素受体)、HER-2(人表皮生长因子受体-2)、Ki-67(细胞周期蛋白)分为五类,不同分子分型决定了系统治疗方案的差异。乳腺癌分子分型如下:
03
乳腺癌治疗靶点
乳腺癌发病机制中的两个主要分子靶点主要是雌激素受体和表皮生长因子2。
雌激素受体α(ERα)在大约70%的浸润性乳腺癌中表达。激素孕酮受体(PR)的表达也是ERα信号的标志。雌激素受体(ER)或PR在至少1%的肿瘤细胞中的表达被归类为HR+,使用内分泌药物下调ER信号是ER阳性或PR阳性乳腺癌的主要系统治疗方法。而对于转移性患者来说目前的一线标准疗法为CDK4/6抑制剂与激素疗法联用。细胞周期蛋白依赖性激酶(cyclin dependent kinases,CDKs)在细胞周期的启动和各个时期的转换调节中发挥重要作用。因癌细胞的基因改变而导致CDK4/6过度活化的表现存在于多个癌种之中,抑制CDK4/6的功能可以阻断癌细胞的有丝分裂过程,还能促进免疫系统攻击癌细胞。
 图4 乳腺癌新出现的靶向途径及药物[2]ERBB2+靶向治疗的发展是乳腺癌治疗中最重要的进展之一。表皮生长因子2(ERBB2,以前称为HER2或HER2/neu),在大约20%的乳腺癌中被扩增或过度表达。具有ERBB2扩增或过度表达的肿瘤是ERBB2阳性,这类乳腺癌的患者受益于ERBB2靶向治疗,包括抗ERBB2抗体(例如曲妥珠单抗和pertuzumab)和小分子酪氨酸激酶抑制剂(lapatinib and neratinib)。Enhertu对低水平HER2乳腺癌患者仍有良好的疗效。
图4 乳腺癌新出现的靶向途径及药物[2]ERBB2+靶向治疗的发展是乳腺癌治疗中最重要的进展之一。表皮生长因子2(ERBB2,以前称为HER2或HER2/neu),在大约20%的乳腺癌中被扩增或过度表达。具有ERBB2扩增或过度表达的肿瘤是ERBB2阳性,这类乳腺癌的患者受益于ERBB2靶向治疗,包括抗ERBB2抗体(例如曲妥珠单抗和pertuzumab)和小分子酪氨酸激酶抑制剂(lapatinib and neratinib)。Enhertu对低水平HER2乳腺癌患者仍有良好的疗效。三阴性乳腺癌约占所有乳腺肿瘤的15%,以缺乏分子靶点ER、PR或ERBB2的表达为特征,化疗为其主要治疗手段。不过近年来这一领域屡有突破。部分患者高表达EGFR、BRCA1/2、VEGF、FGFR,可通过设计靶向这些位点的单克隆抗体抑制肿瘤生长。TROP2是一种I型跨膜糖蛋白,在细胞迁移、增殖、细胞周期进展和转移中发挥重要作用,在乳腺癌、肺癌等人类上皮癌中表达更高,这使TROP2在乳腺癌治疗领域成为了一个很好的靶点。
 图5 三阴性乳腺癌信号转导与肿瘤发生的关键机制[5]
图5 三阴性乳腺癌信号转导与肿瘤发生的关键机制[5]南模生物可提供多种基因修饰小鼠,可用于靶点功能研究及模型开发探索,详见下表:
[1] Bach K, Pensa S, Grzelak M, et al. Differentiation dynamics of mammary epithelial cells revealed by single-cell RNA sequencing. Nat Commun. 2017 Dec 11;8(1):2128.






