长期以来,乳酸都因参与剧烈运动后肌肉发酸或肿瘤细胞代谢而背负“代谢废物”的名声。然而近年来研究发现,乳酸其实是重要的信号分子,不仅可以被细胞吸收利用,还能通过专门的通道和受体参与调节代谢和免疫。2019年,芝加哥大学的赵英明教授团队首次发现蛋白乳酰化修饰1,即乳酸可以像贴便利贴一样贴到蛋白质上:在酶的帮助下,将乳酸加到蛋白的赖氨酸残基上,形成一种全新的蛋白质翻译后修饰(PTMs),进而改变基因表达和蛋白功能。
简而言之,乳酸不再只是能量代谢的“丑小鸭”,而是可以在细胞代谢和基因表达调控之间起到桥梁作用,成为“隐形的指挥官”,默默影响着细胞行为。
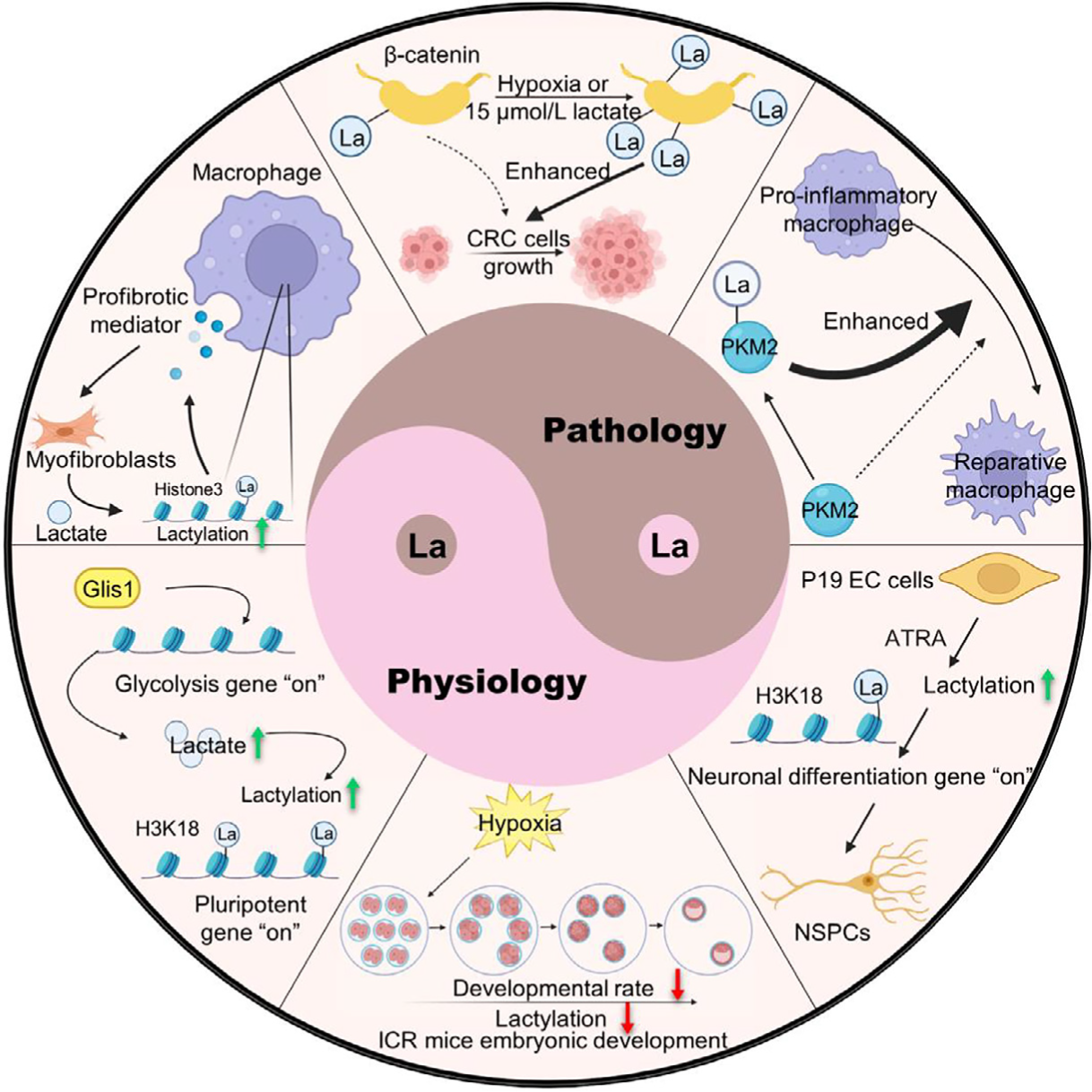
图1,乳酸和蛋白乳酰化修饰的生理病理功能2
肿瘤细胞通过有氧糖酵解供能,产生大量乳酸,导致一个酸性的微环境。肿瘤微环境中的乳酸一方面诱导血管生成和转移,促进肿瘤发生发展,另一方面抑制免疫细胞增值及功能,帮助肿瘤免疫逃逸。乳酸丰富的环境有利于“刹车手”Treg细胞的生长与功能维持,却削弱了“加速器”效应T细胞的促炎与杀伤能力3;同时高乳酸浓度会诱导NK细胞的凋亡,抑制NK细胞中NFAT等转录因子的活化,导致IFN-γ等抗肿瘤因子分泌减少,最终导致NK细胞对肿瘤的杀伤能力显著下降4。
近年来,许多新型蛋白修饰被鉴定,其中就包括蛋白乳酰化。2019年赵英明教授首次发现乳酸可以参与组蛋白乳酰化(H3K18la)并调控基因表达,促进巨噬细胞极化1。此外,蛋白乳酰化在肿瘤中的作用已有较多报道,例如乳酸可通过乳酰化修饰导致P53失活,进而促进肿瘤发展5。而且肿瘤还可利用NBS1的乳酰化促进DNA损伤修复,维持肿瘤细胞的基因组稳定性,进而抵抗放疗和化疗的杀伤效果6。
乳酸和蛋白乳酰化为抗炎抗肿瘤开辟了新视角。组蛋白H3K18la已被确定为胰腺癌免疫微环境的关键表观遗传标志,其水平与患者不良预后显著相关7。同时有研究提出,逆转异常的乳酰化修饰有望成为癌症治疗的新策略8。例如有报道指出靶向APOC2-K70la的抗体可逆转免疫抑制,提升抗PD-1疗效9;降低乳酰化水平,也有助于恢复NK细胞功能4。针对乳酸代谢通路的干预已在探索中,希望能缓解慢性炎症并增强免疫疗效10。可以说,每个人体内都在上演着“乳酸背后的免疫故事”——当我们关注乳酸时,就可能发现调控免疫反应和抗癌的新线索。未来,随着相关基础研究和药物开发的推进,调节蛋白乳酰化或将成为控制炎症、提升抗肿瘤免疫的崭新手段,引起社会和科研界的持续关注。
参考文献
1 Zhang, D. et al. Metabolic regulation of gene expression by histone lactylation. Nature574, 575-580 (2019). https://doi.org/10.1038/s41586-019-1678-1
2 Li, L. et al. Lactate and protein lactylation: the ugly duckling of energy as the sculpture artist of proteins. Sci Bull (Beijing)68, 2510-2514 (2023). https://doi.org/10.1016/j.scib.2023.09.038
3 Watson, M. J. et al. Metabolic support of tumour-infiltrating regulatory T cells by lactic acid. Nature591, 645-651 (2021). https://doi.org/10.1038/s41586-020-03045-2
4 Brand, A. et al. LDHA-Associated Lactic Acid Production Blunts Tumor Immunosurveillance by T and NK Cells. Cell Metabolism24, 657-671 (2016). https://doi.org/10.1016/j.cmet.2016.08.011
5 Zong, Z. et al. Alanyl-tRNA synthetase, AARS1, is a lactate sensor and lactyltransferase that lactylates p53 and contributes to tumorigenesis. Cell187, 2375-2392 e2333 (2024). https://doi.org/10.1016/j.cell.2024.04.002
6 Chen, H. et al. NBS1 lactylation is required for efficient DNA repair and chemotherapy resistance. Nature631, 663-669 (2024). https://doi.org/10.1038/s41586-024-07620-9
7 Yang, J. et al. Histone lactylation-driven feedback loop modulates cholesterol-linked immunosuppression in pancreatic cancer. Gut (2025). https://doi.org/10.1136/gutjnl-2024-334361
8 Rho, H. & Hay, N. Protein lactylation in cancer: mechanisms and potential therapeutic implications. Exp Mol Med57, 545-553 (2025). https://doi.org/10.1038/s12276-025-01410-7
9 Chen, J. et al. Lactylated Apolipoprotein C-II Induces Immunotherapy Resistance by Promoting Extracellular Lipolysis. Adv Sci (Weinh)11, e2406333 (2024). https://doi.org/10.1002/advs.202406333
10 Chen, L. et al. Lactate-Lactylation Hands between Metabolic Reprogramming and Immunosuppression. Int J Mol Sci23 (2022). https://doi.org/10.3390/ijms231911943






