约40%的慢性痛患者会并发抑郁症状,而抑郁症反过来可加重疼痛,形成相互促进的恶性循环,可称为“疼痛-抑郁二联症”或“慢性痛抑郁共病”。因此,聚焦慢性痛抑郁共病的脑区并探索其环路和分子机制是攻克这一难症的有效途径。中脑腹侧被盖区(ventral tegmental area,VTA)是与疼痛和情绪调控密切相关的脑区,腹侧海马(ventral hippocampus,vHPC)是VTA内多巴胺能(dopaminergic,DAergic)神经元的投射靶区之一。但迄今为止,VTA-vHPC通路的神经解剖学特征,其在慢性痛状态下的可塑性变化,以及这条通路是否参与慢性痛抑郁共病调控尚不清楚。近日,西北大学李金莲教授、空军军医大学史娟副教授和西安交通大学赖江华教授团队在生物学期刊《Theranostics》(IF: 12.4)上发表了题为“Modulation of comorbid depression of neuropathic pain by dopamine input from VTA to the ventral hippocampus”的研究论文。该研究采用慢性痛抑郁共病模型,揭示了VTADA-vHPC通路的神经解剖学特征及其在慢性痛抑郁共病中的可塑性变化,运用化学遗传学、光遗传学和行为药理学等技术手段探讨了该通路在慢性痛抑郁共病中的作用,并揭示了相关的受体机制。

向vHPC投射的VTA神经元90%以上为多巴胺能,主要分布于其内侧部;VTADA轴突终末靶向vHPC的CA1、CA3区锥体细胞层及其它分层。采用坐骨神经套管模型(cuff),术后8周,约40%的小鼠出现明显的抑郁样行为,定义为抑郁易感组(susceptible组);其余未出现抑郁样行为的小鼠,则定义为抑郁抵抗组(resilient组)。Western blot,免疫荧光组织化学染色及全细胞膜片钳研究提示,相较于假手术组和抵抗组小鼠,敏感组小鼠VTADA-vHPC通路活性明显下降。使用化学遗传学和光刺激激活VTADA-vHPC通路,可显著改善susceptible组小鼠的抑郁样行为,但对痛行为无明显影响;使用Caspase3凋亡技术消除通路投射神经元,则可以在正常小鼠诱发抑郁表型。另外,在vHPC内预先给予多巴胺D1受体(dopamine D1 receptor,D1R)或多巴胺D2受体(dopamine D2receptor,D2R)拮抗剂可消除光遗传激活该通路产生的抗抑郁效果。运用转基因小鼠和荧光原位杂交相结合,该文最后揭示了vHPC内D1R和D2R的表达:锥体神经元主要表达D1R,部分表达D2R;而GABA能神经元则主要表达D2R。
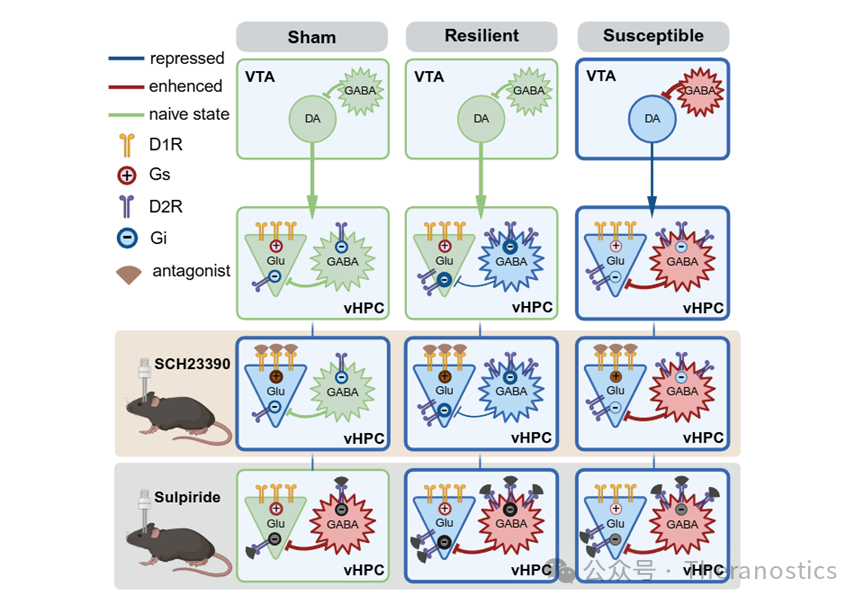
以上结果揭示了VTA-vHPC通路的解剖学特征及其调控慢性痛共病抑郁的作用,为进一步研究和治疗抑郁相关疾病提供了依据。
西北大学李金莲教授、空军军医大学史娟副教授和西安交通大学赖江华教授为本文的共同通讯作者,西北大学姬媛媛讲师为本文的第一作者。
参考文献:Ji Y, Xiao Y, Bai X, Gu J, Ma T, Feng Y, Wang J, Feng Y, Chen T, Lai J, Shi J, Li J. Modulation of comorbid depression of neuropathic pain by dopamine input from VTA to the ventral hippocampus. Theranostics 2025; 15(9):4101-4123. doi: 10.7150/ thno.104394.
原文链接:https://www.thno.org/v15p4101.htm






